Хелаты что это
Что такое хелатная форма удобрений
Купить минеральные удобрения, mineral fertilizers в Санкт-Петербурге
В каталоге товаров/продукции представлены минеральные удобрения - хелат удобрения, хелатные удобрения, простые водорастворимые удобрения, комплексные минеральные удобрения, микроудобрения, категории: chelate fertilizer, chelated fertilizer, simple water-soluble fertilizers, complex fertilizers, microfertilizers, ; хелат удобрения, хелаты, удобрения в форме хелатов, хелатные удобрения, комплексные хелатные удобрения, хелатные микроудобрения, комплексные хелатные микроудобрения, удобрения простые водорастворимые, нитрат кальция (кальциевая селитра), нитрат калия (калиевая селитра), монокалий фосфат, сульфат калия, нитрат магния, сульфат магния, , ,
хелат удобрения, хелатные удобрения
хелат удобрения, хелатные удобрения
Подробнее..простые водорастворимые удобрения
простые водорастворимые удобрения
Подробнее...комплексные минеральные удобрения
комплексные минеральные удобрения
Подробнее...микроудобрения
микроудобрения
Подробнее. ..
..
Купить органо минеральные удобрения, organo mineral fertilizers в Санкт-Петербурге
В каталоге товаров/продукции представлены органо минеральные удобрения - ОМУ удобрения, лигногуматы, категории: WMD fertilizer, Lignohumate, ; , ,
ОМУ удобрения
ОМУ удобрения
Подробнее...лигногуматы
лигногуматы
Подробнее... Инновационные гуминовые препараты и удобрения со склада в Санкт-Петербурге в компании ООО «ХИМСНАБ-СПБ» В каталоге ХИМСНАБ-СПБ можно купить развличные виды органо минеральных удобрений для растений и культур: лигногуматы и ОМУ удобрения.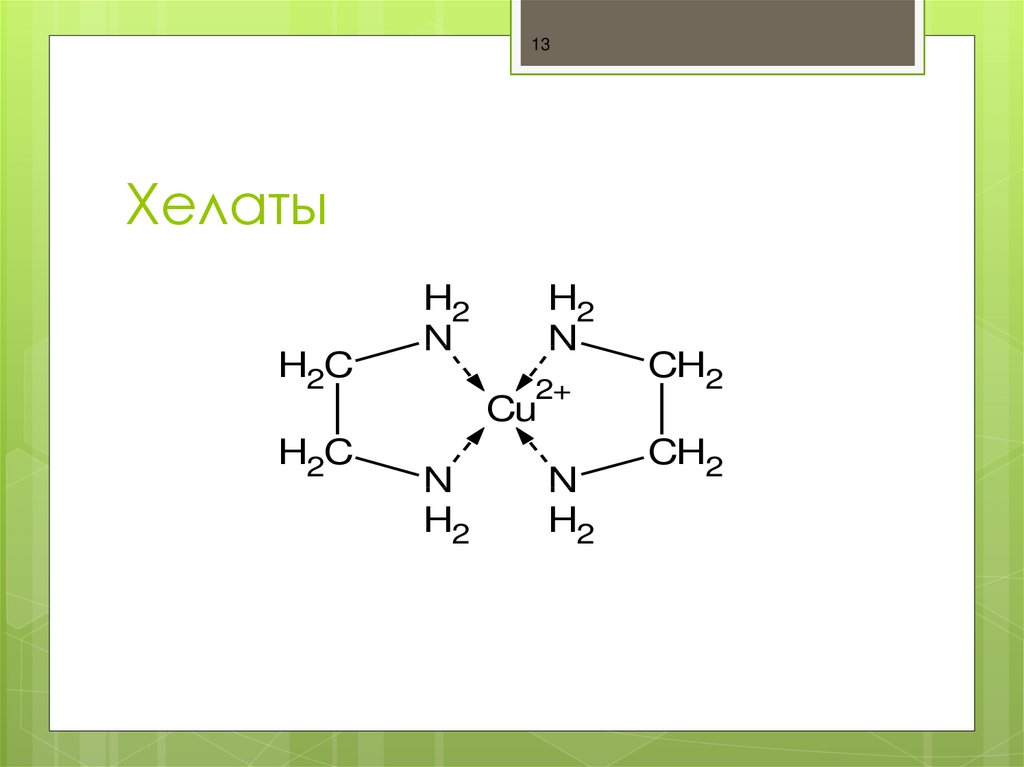 В зависимости от типа удобрения - варианты упаковки, фасовки: мешок или канистра. марка А - порошкообразный продукт; марка АМ - порошкообра...
В зависимости от типа удобрения - варианты упаковки, фасовки: мешок или канистра. марка А - порошкообразный продукт; марка АМ - порошкообра...
Оставьте заявку ON-LINE или позвоните. Менеджер компании ответит на ваши вопросы.
Оставить заявку ON-LINE
Или звонок в рабочее время
Широкий ассортимент
В каталоге компании более 4000 наименований продукции в 200 товарных категориях: химические реактивы, лаб. оборудование и посуда, аксессуары и принадлежности для лабораторий, различные виды удобрений, химическое сырьеи многе другое. Можно подобрать продукцию воспользовавшись фильтром характеристик.
Опт и розница
Осуществляем продажу оптом и в розницу. В каталоге Химснаб-СПБ можно заказать широкий спектр веществ различных квалификаций: «Технический» («тех.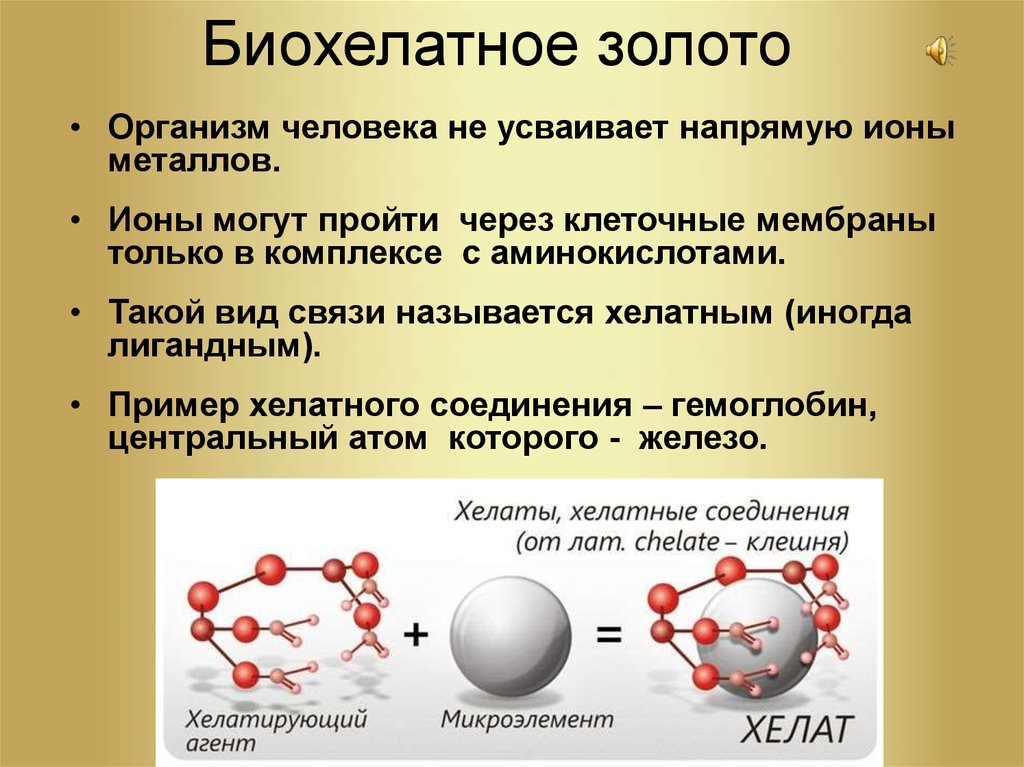 »); «Чистый» («ч.»); «Чистый для анализа» («ч.д.а.»); «Химически чистый» («х.ч.»); «Особо чистый» («ос.ч.»); имп.: неорганические реактивы, органические реактивы, особо чистые вещества, растворы (буферные растворы, растворы для очистки и хранения электродов, растворы для кондуктометров), химическое сырье и компоненты. Продукции для лабораторных исследований.
»); «Чистый» («ч.»); «Чистый для анализа» («ч.д.а.»); «Химически чистый» («х.ч.»); «Особо чистый» («ос.ч.»); имп.: неорганические реактивы, органические реактивы, особо чистые вещества, растворы (буферные растворы, растворы для очистки и хранения электродов, растворы для кондуктометров), химическое сырье и компоненты. Продукции для лабораторных исследований.
Проверенные поставщики
Компания реализует товары и продукцию только от проверенных поставщиков гарантирующих качестно продукции.
Консультация по продукции
Менеджеры компании проконсультируют вас по ассортименту реализуемой продукции, звоните в рабочее время
Доставка
География потребителей выходит за пределы России, компания "Химснаб-СПБ" осуществляет доставку приобретаемых товаров и продукции по Санкт-Петербургу, Ленинрадской обл, России и странам СНГ.
Индивидуальный подход
Строим свое сотрудничество с клиентом с учетом всех пожеланий клиента. Гибкий и индивидуальный подход к каждому клиенту, ориентированность на долгосрочные партнерские отношения, строгое соблюдение оговоренных сроков и предоставления документов заказчику являются неоспоримыми преимуществами компании "Химснаб-СПБ". Мы заботимся о том, чтобы каждый наш клиент остался доволен приобретаемой продукцией и полученным результатом, который является нашим общим успехом!
Малотоннажная химия
Реализация продукции малотоннажной химии: продукция химической и нефтехимической промышленности. Малотоннажная химия дает возможность на скромном оборудовании и в небольших объемах производить дорогостоящие модификаторы, пластификаторы, ингибиторы и другие микродобавки, способные наделять конечный продукт новыми свойствами
Комплексное снабжение, оснащение
Компания Химснаб-СПБ имеет многолетний опыт работы на рынке химической продукции и лабораторного оборудования. Компания тесно сотрудничает со многими промышленными и производственными организациями и имеет возможность осуществлять комплексное снабжение и оснащение предприятии различных отраслений промышленности необходимым оборудованием и расходными материалами.
Компания тесно сотрудничает со многими промышленными и производственными организациями и имеет возможность осуществлять комплексное снабжение и оснащение предприятии различных отраслений промышленности необходимым оборудованием и расходными материалами.
Предствленная информация на страницах данного интернет-сайта и в каталоге продукции носит исключительно информационный характер и ни при каких условиях не является публичной офертой, определяемой положениями Статьи 437 (2) Гражданского кодекса РФ. Для получения подробной информации о наличии и стоимости указанных товаров и (или) услуг,обращайтесь к менеджерам отдела продаж: форма обратной связи, e-mail, телефон.
Реализация продукции для сельского хозяйства, химической, строительной, нефтегазовой, металлургической, текстильной, кожевенной, и других отраслей промышленности.
7 812-337-18-93
Возникли вопросы, звоните: пн-пт с 9:00 до 17:00 или оставьте Ваш телефон и мы Вам перезвоним.
Возможности «ХИМСНАБ-СПБ»:
Предлагаем широкие возможности для комплектации химической продукцией производства и исследовательских лабораторий в различных отраслях промышленности.
Приемущества «ХИМСНАБ-СПБ»:
Комплексное снабжение:
«ХИМСНАБ-СПБ» - Ваш надежный поставщик
Поставка химической продукции и лабораторного оборудования является ключевым направлением деятельности компании с 1996 года.
Компания «ХИМСНАБ-СПБ» успешно осуществляет поставку широкого спектра лабороторного оборудования, приборов и другой химической продукции на рынке Северо-Запада Российской Федерации.
- Широкий ассортимент продукции
- Опт и розница
- Консультация по продукции
- Доставка транспортными компаниями
- Индивидуальный подход
- Проверенные поставщики
- Малотоннажная химия
- Комплексное снабжение, оснащение
О компании Химснаб-СПБ
- хелаты сульфаты ЕДТА ДТРА ЕДДНА хелатирующий агент комплексные удобрения
Похожие статьи
Марки удобрений Акварин комплексные водорастворимые минеральные удобрения
- 30 ноября 2008
дефицит элементов питания растений, недостаток минеральных удобрений
- 01 апреля 2015
дефицит кобальта у растений, недостаток элемента кобальт
- 02 апреля 2015
важные микроэлементы для развития и роста растений
- 01 мая 2015
Хелатное удобрение способствует активизации ферментов и процессы фотосинтеза в структуре растений
- 01 июня 2015
Хелатное удобрение способствует повышению морозоустойчивости и засухоустойчивости
- 02 июня 2015
Хелатное удобрение способствует ускорению роста и развития стеблей и листьев растения
- 06 июня 2015
Хелатное удобрение способствует повышению урожайности культур
- 07 июня 2015
Хелатное удобрение способствует улучшению качества выращенного урожая
- 08 июня 2015
Концентрированный растворимый комплекс Akvarin
- 01 января 2016
Удобрения для листовых подкормок растений Akvarin
- 02 января 2016
Особенности внесение водорастворимых комплексных минеральных удобрений
- 03 января 2016
Хелаты | это.
 .. Что такое Хелаты?
.. Что такое Хелаты?| В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. |
Хелат иона металла и этилендиаминтетрауксусной кислоты
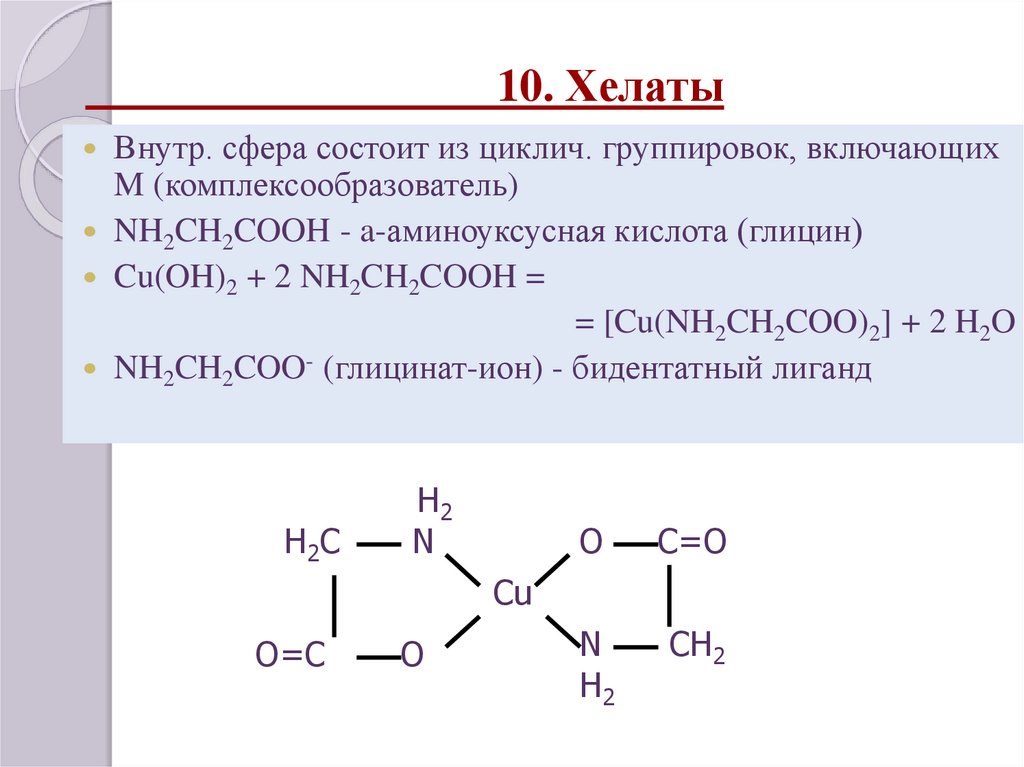
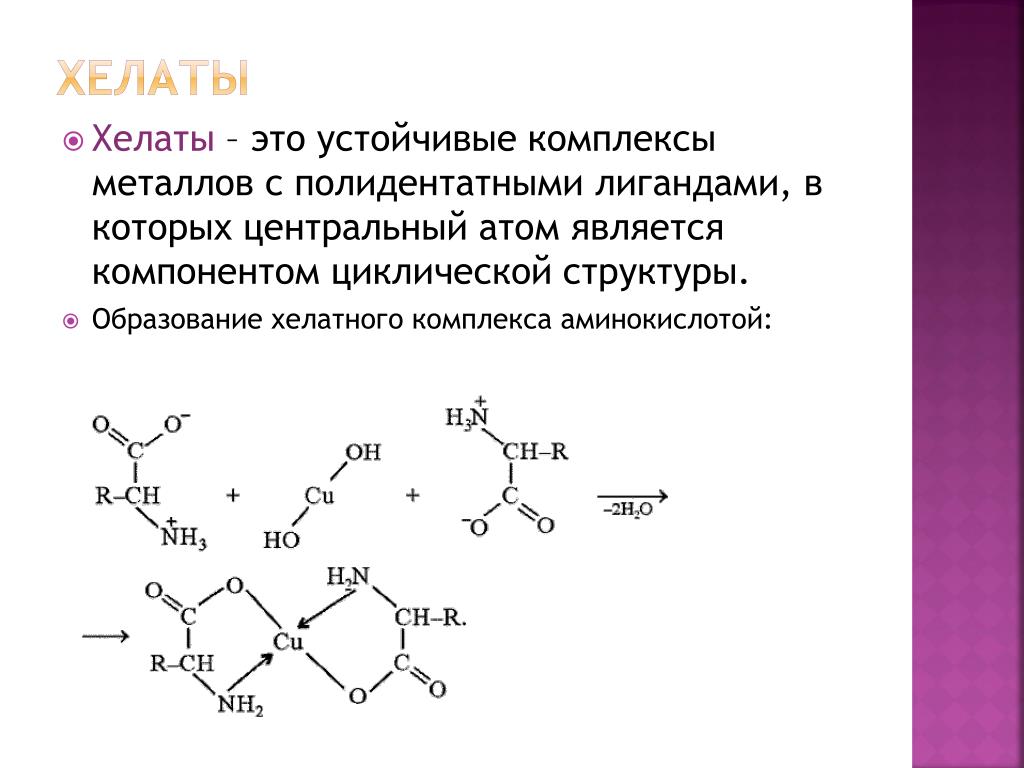
Хелаты, хелатные соединения (от лат. chelate — клешня), также внутрикомплексные или циклические комплексные соединения — клешневидные комплексные соединения, образуются при взаимодействии ионов металлов с полидентатными (то есть имеющими несколько донорных центров) лигандами. Хелаты содержат центральный ион (частицу) — комплексообразователь и координированные вокруг него лиганды. Внутренняя сфера хелата состоит из циклических группировок, включающих комплексообразователь.
Иногда разделяют понятия хелатного и внутрикомплексного соединения. Второе определение применяют в случае, когда атом-комплексообразователь замещает протон лиганда в соединении.
Второе определение применяют в случае, когда атом-комплексообразователь замещает протон лиганда в соединении.
Хелаты используют в химии для разделения, концентрирования и аналитического определения различных элементов. В медицине и сельском хозяйстве - для введения в пищу микроэлементов (Fe, Cu, Mn и т.д.), благодаря высокой усваиваемости хелатных комплексов по сравнению со свободными ионами металлов.
Содержание
|
Пример
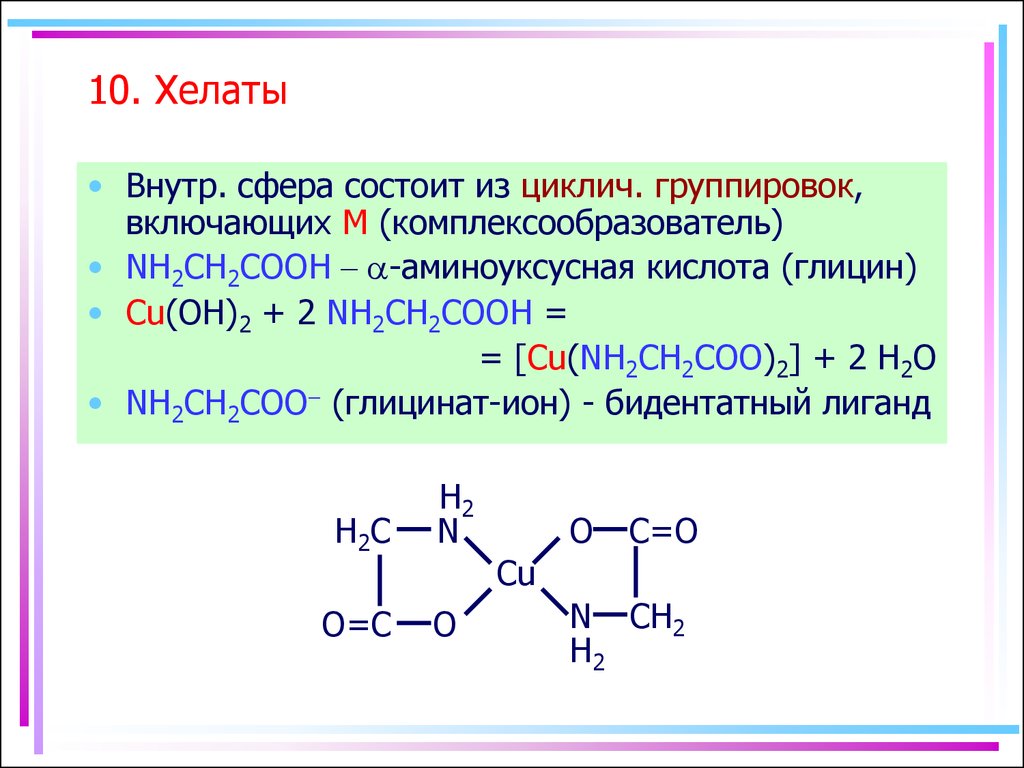
Аминоуксусная кислота (глицин) может реагировать с гидроксидом меди с образованием сине-фиолетового прочного комплекса, растворимого в воде:
Cu(OH)2 + 2 NH2CH2COOH = [Cu(NH2CH2COO)2] + 2H2O
Лиганд NH2CH2COO− (глицинат-ион) относят к категории бидентатных лигандов, образующих две химические связи с комплексообразователем — через атом кислорода карбоксильной группы и через атом азота аминогруппы.
Внутренняя сфера комплекса содержит два замкнутых пятичленных цикла, в связи с чем полученный комплекс отличается высокой устойчивостью. Константа образования диглицинатомеди(II) β2 равна 1,8·1015.
Реакция Чугаева
- Не следует путать с другой реакцией Чугаева.
Важное значение в химико-аналитической практике имеет открытая Л. А. Чугаевым реакция взаимодействия диметилглиоксима с катионами никеля(II) в аммиачной среде, приводящая к образованию малорастворимого ярко-красного комплексного соединения — бис(диметилглиоксимато)никеля(II).
Функции лиганда в этом комплексном соединении выполняет диметилглиоксимат-анион, образующий две химические связи с комплексообразователем, вследствие чего получаются два пятичленных циклических фрагмента, упрочняющих комплекс.
Строение получаемого хелата плоское; благодаря внутримолекулярным водородным связям (между лигандами) образуются еще две шестичленные циклические группировки, включающие атомы никеля и стабилизирующие частицу комплекса.
Реакция Чугаева очень чувствительна и селективна по отношению к катионам никеля(II) и позволяют уверенно определить его присутствие в любых химических объектах. Получаемый хелатный комплекс используется как пигмент.
Литература
Хелаты/Химическая энциклопедия. Т. 5 в 5 т. - М.: Большая Российская Энциклопедия, 1998 - с.224-225.
Стид Дж.В., Этвуд Дж.Л.Супрамолекулярная химия. Т. 1. - М.: Академкнига, 2007 - с. 38-41.
См. также
- Комплексоны
Хелаторная терапия: цель, процедура и побочные эффекты
Автор: WebMD Editorial Contributors
В этой статье
- Как это работает?
- Какие другие заболевания он лечит?
- Побочные эффекты
- На что обратить внимание
Когда в организме накапливаются такие металлы, как свинец, ртуть, железо и мышьяк, они могут быть токсичными. Хелаторная терапия — это лечение, при котором используются лекарства для удаления этих металлов, чтобы они не вызывали у вас болезни.
Некоторые поставщики альтернативных медицинских услуг также используют его для лечения сердечных заболеваний, аутизма и болезни Альцгеймера. Но очень мало доказательств того, что это работает в этих условиях. На самом деле, хелаторная терапия может вызвать серьезные побочные эффекты, включая смерть, особенно если ее использовать неправильно.
Как это работает?
В хелатной терапии используются специальные препараты, которые связываются с металлами в крови. Вы получаете хелатирующее лекарство через внутривенную (IV) трубку в руке. Он также доступен в форме таблеток. Как только лекарство прикрепится к металлу, ваше тело выведет их обоих через мочу.
Металлы, которые можно удалить с помощью хелатирующей терапии, включают свинец, ртуть и мышьяк. Прежде чем вы получите это лечение, ваш врач проведет анализ крови, чтобы убедиться, что у вас отравление металлами.
Какие другие состояния он лечит?
Некоторые поставщики естественных медицинских услуг и компании, производящие пищевые добавки, заявляют, что используют хелатирующую терапию для уменьшения симптомов аутизма, болезни Альцгеймера или сердечно-сосудистых заболеваний. Тем не менее, это лечение одобрено Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) только для лечения отравления металлами.
Тем не менее, это лечение одобрено Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) только для лечения отравления металлами.
Вот что показывают исследования в отношении лечения хелаторами этих трех состояний:
Аутизм. Использование хелатотерапии для лечения этого состояния основано на идее, что аутизм вызывается ртутью в детских вакцинах. Исследования доказали, что эта идея ошибочна. Но некоторые медицинские работники также считают, что удаление металлов из организма может улучшить симптомы аутизма.
Американская академия педиатрии (AAP) заявляет, что нет никаких доказательств того, что хелатирование является эффективным средством лечения аутизма и может быть опасным. Один ребенок с этим заболеванием умер после такого лечения. AAP не рекомендует использовать хелатную терапию при аутизме, за исключением клинических испытаний.
Болезнь Альцгеймера. У пациентов с этим заболеванием аномальные белки, называемые тау- и бета-амилоидами, накапливаются в головном мозге и повреждают его. На сегодняшний день никакое лечение не может остановить или обратить вспять это заболевание.
На сегодняшний день никакое лечение не может остановить или обратить вспять это заболевание.
Некоторые исследователи считают, что накопление металлов, таких как медь, железо и цинк, также может играть роль в развитии болезни Альцгеймера. Если это правда, хелаторная терапия может иметь место в лечении этого заболевания. Пока нет никаких доказательств того, что это работает.
Болезнь сердца. Вы получаете это, когда жировые отложения, называемые бляшками, образуются в ваших артериях. Эти вещества вызывают сужение кровеносных сосудов. Они также делают их менее гибкими, поэтому через них может проходить меньше крови. Артериальные бляшки содержат кальций. Хелатирующий препарат динатрия ЭДТА связывается с этим минералом. Идея состоит в том, что хелаторная терапия выводит его из кровеносных сосудов. Он также удаляет бляшки.
В 2002 году Национальные институты здравоохранения провели большое исследование хелатотерапии под названием TACT. Было обнаружено, что это лечение несколько снижает риск сердечных приступов, инсультов и других проблем с сердцем.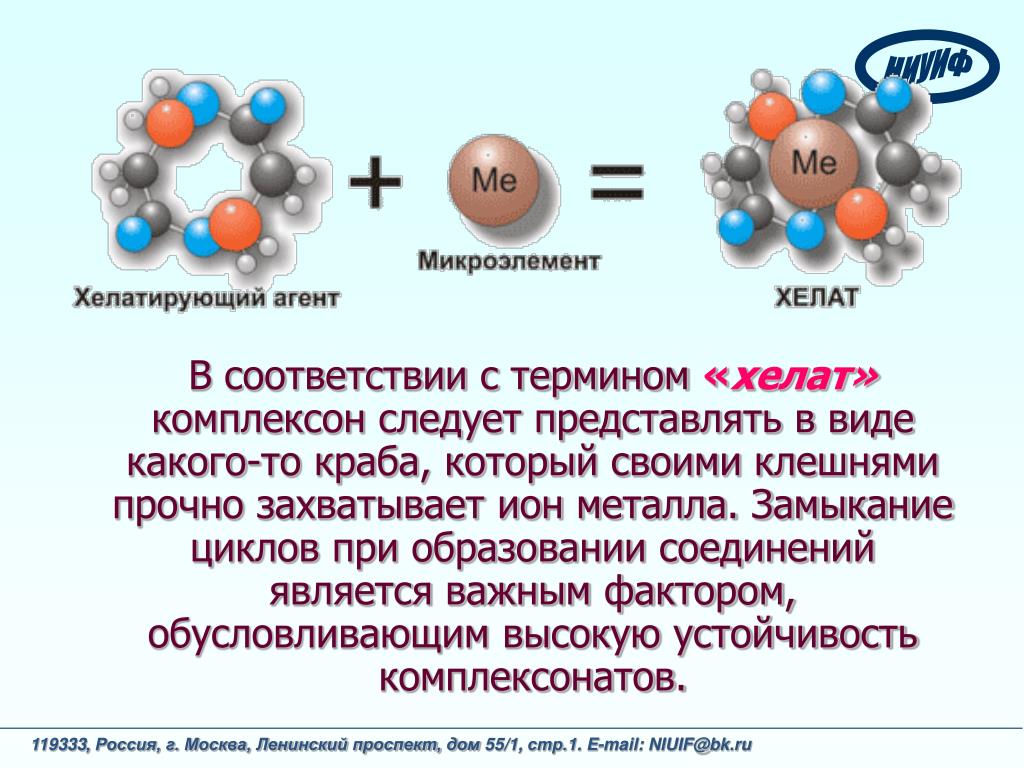 Но это работало только у людей с диабетом. Исследование не нашло достаточных доказательств того, что он лечит сердечные заболевания. И до сих пор FDA не одобрило это лечение этого заболевания. Новое исследование под названием TACT2 может дать больше информации.
Но это работало только у людей с диабетом. Исследование не нашло достаточных доказательств того, что он лечит сердечные заболевания. И до сих пор FDA не одобрило это лечение этого заболевания. Новое исследование под названием TACT2 может дать больше информации.
Побочные эффекты
Когда хелатирующая терапия используется правильно и по правильной причине, она может быть безопасной. Наиболее распространенным побочным эффектом является жжение в области, где вы получаете капельницу. Вы также можете испытывать лихорадку, головную боль, тошноту или рвоту.
Хелатирующие препараты могут связываться и удалять некоторые металлы, необходимые вашему организму, такие как кальций, медь и цинк. Это может привести к дефициту этих важных веществ. У некоторых людей, прошедших хелаторную терапию, также наблюдается низкий уровень кальция в крови и повреждение почек.
На что обратить внимание
Сегодня хелатирующая терапия одобрена только FDA для лечения отравления металлами. Просто недостаточно доказательств, чтобы поддержать его использование для любого другого состояния. И, как показывают исследования, это может быть опасно, если оно используется по несанкционированной причине.
Просто недостаточно доказательств, чтобы поддержать его использование для любого другого состояния. И, как показывают исследования, это может быть опасно, если оно используется по несанкционированной причине.
Остерегайтесь любых онлайн-продуктов или поставщиков медицинских услуг, которые пытаются использовать это лечение для других целей, таких как болезнь Альцгеймера или болезни сердца. Хелатирующие продукты также не одобрены для домашнего использования. Их можно использовать только по назначению врача. Если вы думаете о том, чтобы попробовать хелаторную терапию, поговорите со своим врачом.
Справочник по здоровью и балансу
- Сбалансированная жизнь
- Take It Easy
- Процедуры CAM
Chelation - Chelation LibreTexts
-
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 525
- Роберт Дж.
 Ланкашир
Ланкашир - Университет Вест-Индии в Моне
Ион металла в растворе существует не изолированно, а в сочетании с лигандами (такими как молекулы растворителя или простые ионы) или хелатирующими группами, образуя комплексные ионы или координационные соединения. Эти комплексы содержат центральный атом или ион, часто переходный металл, и группу ионов или нейтральных молекул, окружающих его.
Введение
Многие комплексы представляют собой относительно нереакционноспособные соединения, которые остаются неизменными на протяжении всей последовательности химических или физических операций и часто могут быть выделены в виде стабильных твердых веществ или жидких соединений. Другие комплексы имеют гораздо более преходящее существование и могут существовать только в растворе или быть высокореакционноспособными и легко превращаться в другие соединения. Все металлы образуют комплексы, хотя степень их образования и характер очень сильно зависят от электронной структуры металла. Концепция металлокомплекса возникла в работах Альфреда Вернера, который в 1913 был удостоен первой Нобелевской премии по неорганической химии.
Концепция металлокомплекса возникла в работах Альфреда Вернера, который в 1913 был удостоен первой Нобелевской премии по неорганической химии.
Комплексы могут быть неионными (нейтральными), катионными или анионными, в зависимости от зарядов, переносимых центральным ионом металла и скоординированными группами. Общее количество точек присоединения к центральному элементу называется координационным числом, и оно может варьироваться от 2 до более чем 12, но обычно равно 6. Термин «лиганд» происходит от латинского слова ligare , что означает «связывать»). впервые использован Альфредом Стоком в 1916 в отношении химии кремния. Впервые термин был использован в британском журнале Х. Ирвингом и Р.Дж.П. Williams in Nature , 1948, 162, 746 в своей статье, описывающей то, что сейчас называется рядом Ирвинга-Уильямса.
Лиганды могут быть дополнительно охарактеризованы как монодентатные, бидентатные, тридентатные и т. д., где введено понятие зубов (зуб) , отсюда понятие угла прикуса и т.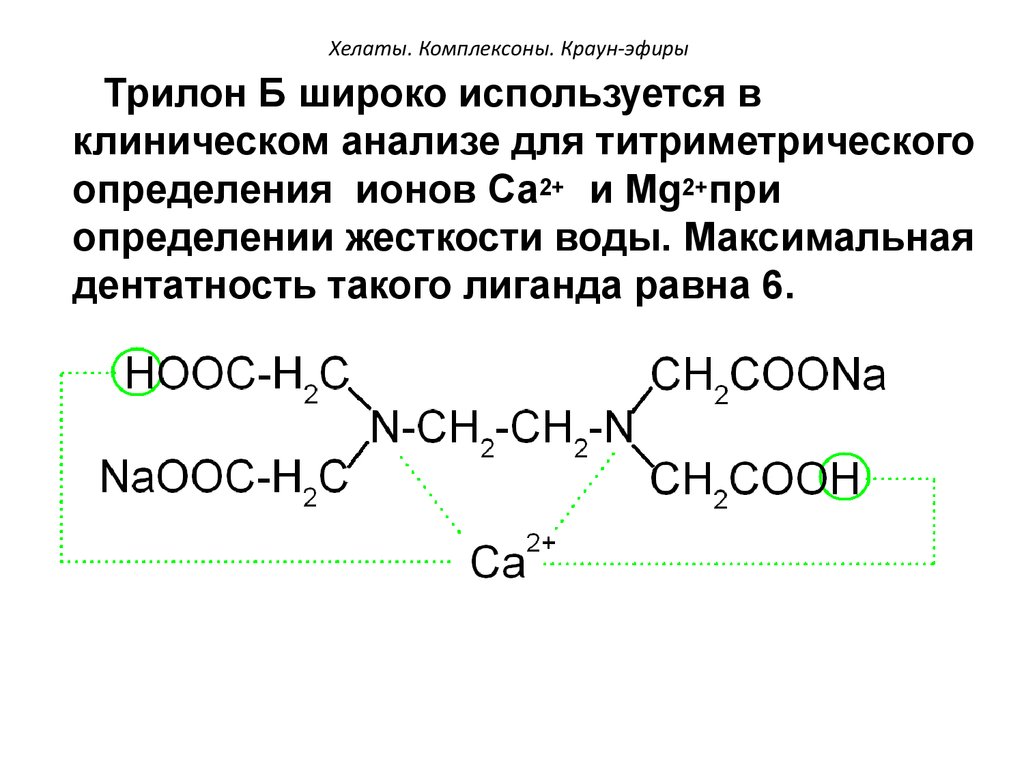 д. Термин хелат впервые был применен в 1920 г. сэром Гилбертом Т. Морган и Х.Д.К. Дрю [ J. Chem. соц. , 1920, 117, 1456], который заявил: «Прилагательное хелат, происходящее от большой клешни или chela (chely-греч.) омара или других ракообразных, предполагается для суппортоподобных групп, которые функционируют как две ассоциированные единицы. и прикрепляются к центральному атому, образуя гетероциклические кольца».
д. Термин хелат впервые был применен в 1920 г. сэром Гилбертом Т. Морган и Х.Д.К. Дрю [ J. Chem. соц. , 1920, 117, 1456], который заявил: «Прилагательное хелат, происходящее от большой клешни или chela (chely-греч.) омара или других ракообразных, предполагается для суппортоподобных групп, которые функционируют как две ассоциированные единицы. и прикрепляются к центральному атому, образуя гетероциклические кольца».
Комплексообразование металлов представляет большой интерес. Его изучают не только химики-неорганики, но и физико- и органические химики, биохимики, фармакологи, молекулярные биологи и экологи.
Термодинамическая стабильность
«Стабильность комплекса в растворе» относится к степени ассоциации между двумя частицами, находящимися в состоянии равновесия. Качественно, чем больше ассоциация, тем выше стабильность соединения. Величина константы равновесия (стабильности или образования) для ассоциации количественно выражает стабильность.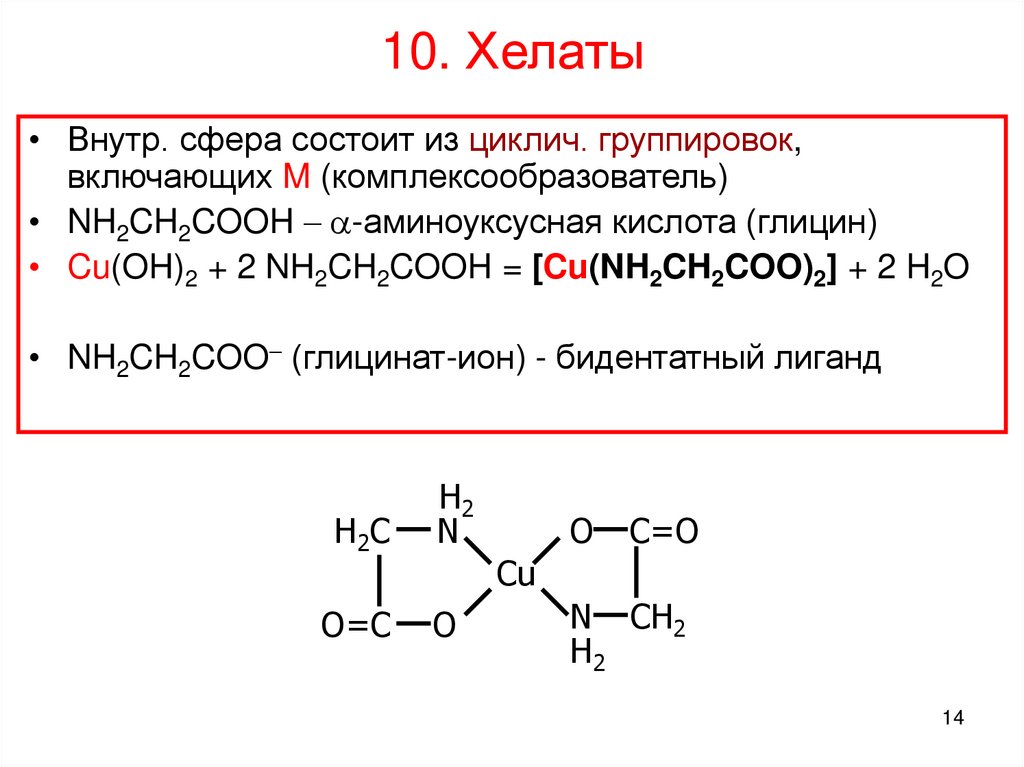 Таким образом, если мы имеем реакцию вида:
Таким образом, если мы имеем реакцию вида:
\[M + 4L \rightarrow ML_4\]
, то чем больше константа устойчивости, тем больше доля \(ML_4\), которая присутствует в растворе. Свободные ионы металлов редко существуют в растворе, поэтому \(M\) обычно окружены молекулами растворителя, которые будут конкурировать с молекулами лиганда \(L\) и последовательно замещаться ими. Например в воде:
\[ M(H_2O)_4 + L \rightleftharpoons M(H_2O)_3L + H_2O\]
\[ M(H_2O)_3L + L \rightleftharpoons M(H_2O)_2L_2 + H_2O\]
Однако для простоты , мы обычно игнорируем эти молекулы растворителя и записываем четыре константы стабильности следующим образом:
\(M + L → ML\) с \[K_1 = \dfrac{[ML]}{[M] [L]}\]
\(ML + L → ML_2\) с \[K_2 = \dfrac{[ML_2]}{[ML] [L]}\]
\(ML_2 + L → ML_3\) с \[K_3 = \dfrac{ [ML3]}{[ML_2] [L]}\]
\(ML_3 + L → ML_4\) с \[K_4 = \dfrac{[ML_4]}{[ML_3] [L]}\] 94}\]
Таким образом, ступенчатая и общая константы устойчивости связаны следующим образом: K_1 \times K_2 \times K_3 \times K_4 \times . {2+}\): 94}\]
{2+}\): 94}\]
Добавление четырех аммиачных групп к меди показывает картину, обнаруженную для большинства констант образования, в том, что последовательные константы стабильности уменьшаются. В этом случае четыре константы:
\[\log K_1 =4.0,\]
\[\log K_2 =3.2,\]
\[\log K_3 =2.7,\]
\[\ лог К_4 =2,0\; \текст{или} \; \log \beta_4 =11.9\]
Обратите внимание на определения: в некоторых текстах \(\beta_4\) может упоминаться как константа нестабильности или 9{2+}]}\]
Однако это определение не используется здесь (Таблица E4) и должно сравниваться с уравнением для константы пласта, приведенным ранее.
Обычно процесс связывания металлов представляют в виде серии ступенчатых равновесий, которые приводят к константам стабильности, которые могут численно варьироваться от сотен до огромных значений, таких как 10 35 и более. Это
100 000 000 000 000 000 000 000 000 000 000 000,0
По этой причине они обычно представляются как логарифмы.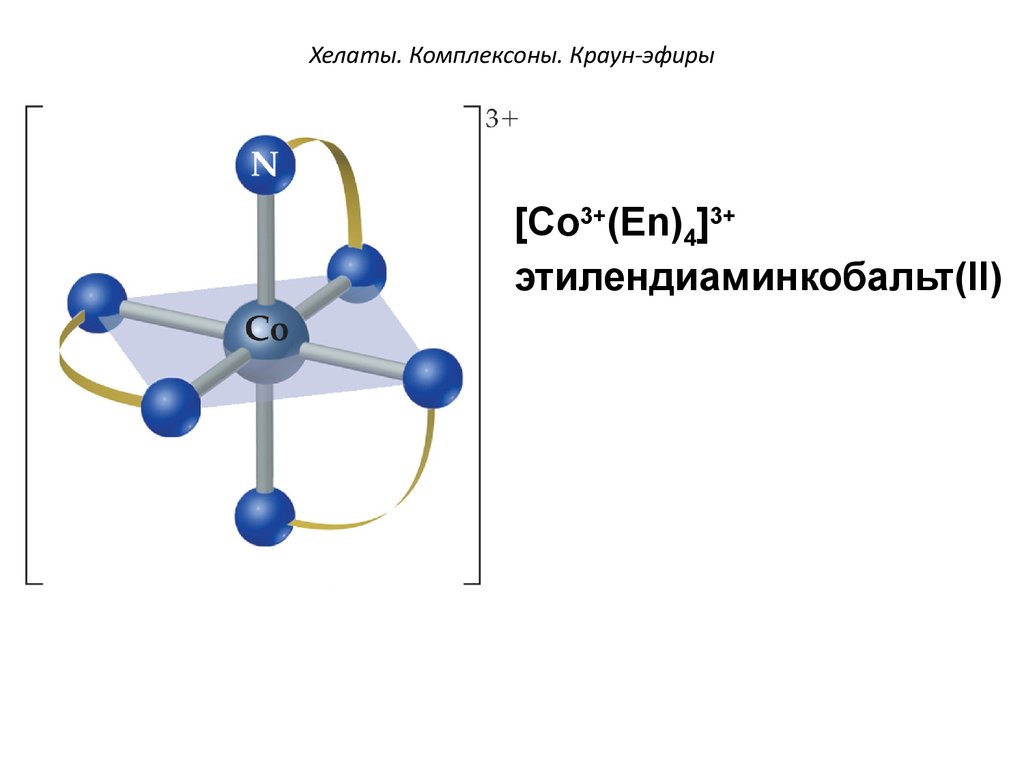 Итак, войдите 9о\]
Итак, войдите 9о\]
Ниже приведены три таблицы констант образования и термодинамических свойств примеров комплексов лиганд-металл; более полную таблицу можно найти в Таблице E4.
| Количество лигандов | ΔG° (кДжмоль -1 ) | ΔH° (кДжмоль -1 ) | ΔS° (JK-1mol -1 ) | журнал β |
|---|---|---|---|---|
| 2 NH 3 (1 англ.) | -28,24 (-33,30) | -29,79 (-29,41) | -5.19 (+13.05) | 4,95 (5,84) |
4 NH 3 (2 англ.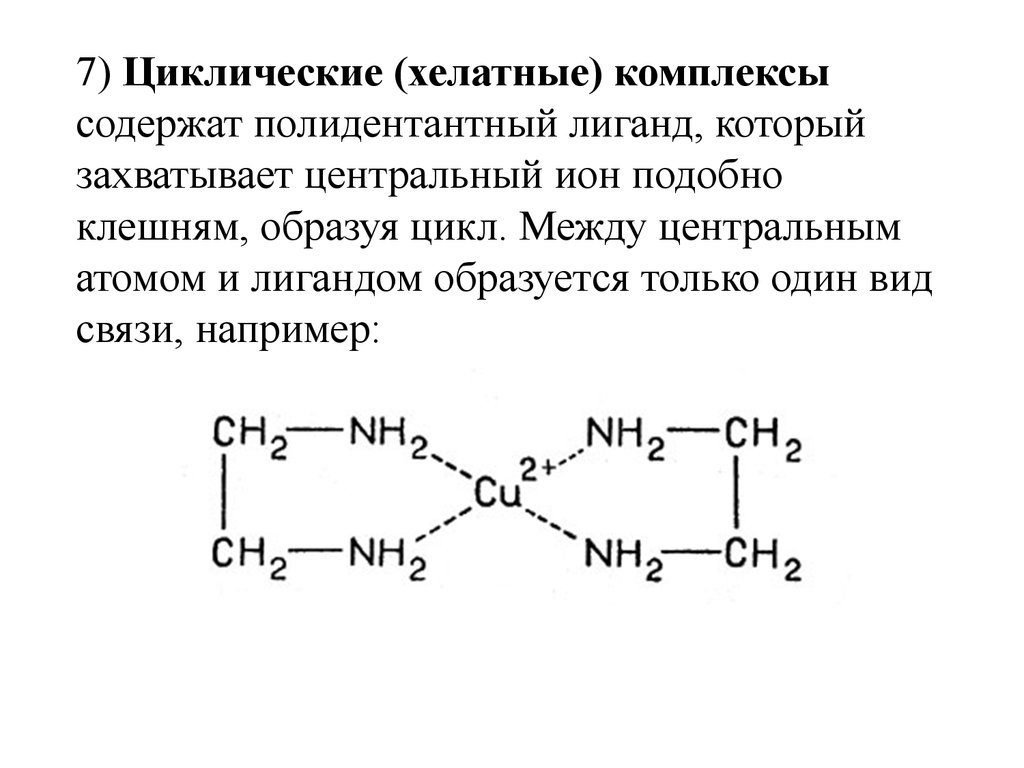 ) ) | -42,51 (-60,67) | -53,14 (-56,48) | -35,50 (+13,75) | 7,44 (10,62) |
| Количество лигандов | журнал β | ΔG° (кДжмоль -1 ) |
|---|---|---|
| 2 py (1 двойник) | 3,5 (6,9) | -20 (-39) |
| 4-х (2-х байтовый) | 5,6 (13,6) | -32 (-78) |
| 6 py (3 двойных) | 9,8 (19,3) | -56 (-110) |
| Количество лигандов | журнал β | ΔG° (кДжмоль -1 ) |
|---|---|---|
| 1 НХ 3 | 2,8 | -16 |
| 2 NH 3 (1 англ.) | 5,0 (7,51) | -28,5 (-42,8) |
| 3 НХ 3 | 6,6 | -37,7 |
| 4 NH 3 (2 англ.) | 7,87 (13,86) | -44,9 (-79,1) |
| 5 НХ 3 | 8,6 | -49,1 |
6 NH 3 (3 англ. ) ) | 8,61 (18,28) | -49,2 (-104,4) |
Эффект хелатирования
Эффект хелатирования можно увидеть, сравнив реакцию хелатирующего лиганда и иона металла с соответствующей реакцией с участием сопоставимых монодентатных лигандов. Например, сравнение связывания 2,2'-бипиридина с пиридином или 1,2-диаминоэтана (этилендиамина=ен) с аммиаком. Уже много лет известно, что сравнение такого типа всегда показывает, что комплекс, образующийся в результате координации с хелатирующим лигандом, представляет собой гораздо более термодинамически стабилен . Это можно увидеть, взглянув на значения добавления двух монодентатов по сравнению с добавлением одного бидентата, или добавления четырех монодентатов по сравнению с двумя бидентатами, или добавления шести монодентатов по сравнению с тремя бидентатами.
Ряд точек следует выделить из констант формации в Таблице E4.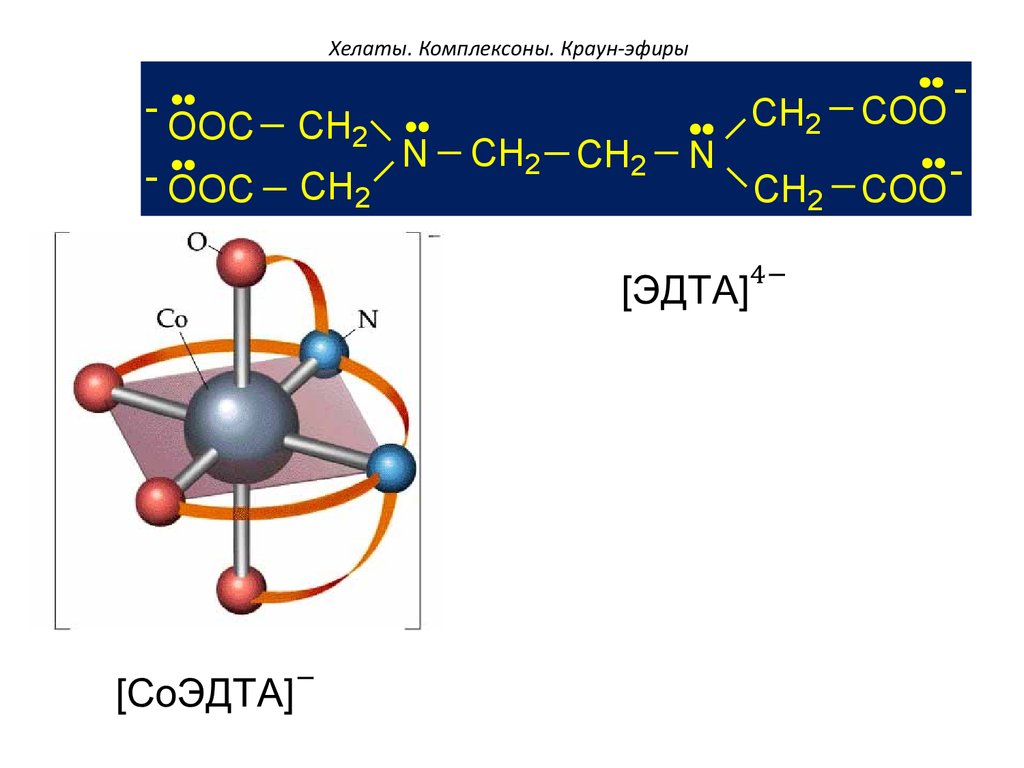 В таблице \(\PageIndex{1}\) видно, что значения ΔH° для стадий образования практически идентичны, то есть выделение тепла происходит примерно в одинаковой степени независимо от того, образуется ли комплекс с участием монодентатных лигандов или бидентатных лигандов. . Видно, что значительно меняется член ΔS°, который меняется с отрицательного (неблагоприятного) на положительный (благоприятный). Также обратите внимание на резкое увеличение размера члена ΔS° при добавлении двух по сравнению с добавлением четырех монодентатных лигандов. (от -5 до -35 ДжК -1 моль -1 ). Что это означает, если мы считаем, что ΔS° дает меру беспорядка?
В таблице \(\PageIndex{1}\) видно, что значения ΔH° для стадий образования практически идентичны, то есть выделение тепла происходит примерно в одинаковой степени независимо от того, образуется ли комплекс с участием монодентатных лигандов или бидентатных лигандов. . Видно, что значительно меняется член ΔS°, который меняется с отрицательного (неблагоприятного) на положительный (благоприятный). Также обратите внимание на резкое увеличение размера члена ΔS° при добавлении двух по сравнению с добавлением четырех монодентатных лигандов. (от -5 до -35 ДжК -1 моль -1 ). Что это означает, если мы считаем, что ΔS° дает меру беспорядка?
В случае комплексообразования Ni 2 + с аммиаком или 1,2-диаминоэтаном путем перезаписи равновесий получают следующие уравнения.
Используя константу равновесия для реакции (3 выше), где три бидентатных лиганда заменяют шесть монодентатных лигандов , мы находим, что при температуре 25°C: 9{-1}\)
- TΔS° = -25 кДж моль -1
и при 25C (298K)
ΔS° = +88 Дж К -1 моль -1
В течение многих лет, числа были неправильно записано в учебниках.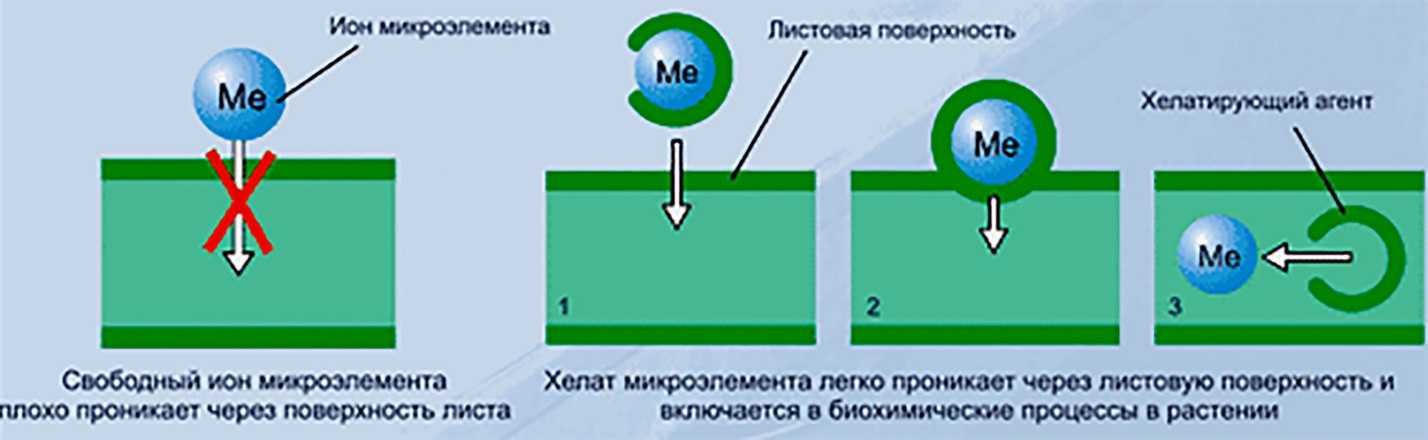 Например, третье издание «Основы неорганической химии» Ф.А. Коттона, Г. Уилкинсона и П.Л. Gaus, John Wiley & Sons, Inc., 1995, на стр. 186 дает следующие значения:-T∆S° = -55 кДж моль -1
Например, третье издание «Основы неорганической химии» Ф.А. Коттона, Г. Уилкинсона и П.Л. Gaus, John Wiley & Sons, Inc., 1995, на стр. 186 дает следующие значения:-T∆S° = -55 кДж моль -1
Из этих неправильных чисел они сделали вывод, что хелатный эффект был по существу энтропийным эффектом, поскольку вклад T∆S° был почти в 5 раз больше, чем ∆H°.
Фактически, разбивка ΔG° на ΔH° и TΔS° показывает, что эти два члена почти равны (-29 и -25 кДж моль -1 соответственно), а член ΔH° немного больше! Найденный энтропийный член все же намного больше, чем для реакций с нехелатирующим замещением лиганда на ион металла. Как мы можем объяснить этот усиленный вклад энтропии? Одно из объяснений состоит в том, чтобы подсчитать количество видов в левой и правой частях приведенного выше уравнения.
Видно, что слева 4 вида, а справа 7 видов, т.е. чистый прирост 3 вида происходит по мере протекания реакции. Это может объяснить увеличение энтропии, поскольку оно представляет собой увеличение беспорядка в системе.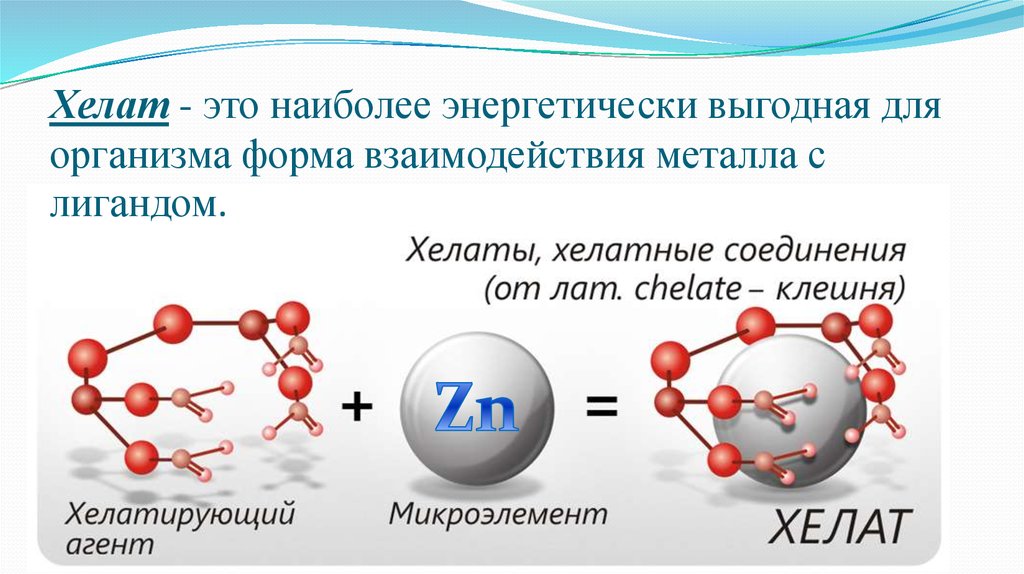 Альтернативная точка зрения исходит из попытки понять, как могут протекать реакции. Для образования комплекса с 6 монодентатами требуется 6 отдельных благоприятных столкновений между ионом металла и молекулами лиганда. Для образования комплекса трис-бидентатного металла требуется начальное столкновение, чтобы первый лиганд прикрепился одним плечом, но помните, что другое плечо всегда будет рядом, и требуется только вращение другого конца, чтобы лиганд мог сформировать хелат. звенеть.
Альтернативная точка зрения исходит из попытки понять, как могут протекать реакции. Для образования комплекса с 6 монодентатами требуется 6 отдельных благоприятных столкновений между ионом металла и молекулами лиганда. Для образования комплекса трис-бидентатного металла требуется начальное столкновение, чтобы первый лиганд прикрепился одним плечом, но помните, что другое плечо всегда будет рядом, и требуется только вращение другого конца, чтобы лиганд мог сформировать хелат. звенеть.
Если рассматривать этапы диссоциации, то при смещении монодентатной группы она теряется в объеме раствора. С другой стороны, если один конец двузубой группы смещен, другая рука все еще прикреплена, и дело только в том, что рука вращается вокруг, и ее можно снова прикрепить. Оба условия благоприятствуют образованию комплекса с бидентатными группами, а не с монодентатными.
Ссылки
- Увлекательный обзор происхождения и распространения термина «лиганд» в химии см.
 : W.H. Брок, К.А. Дженсен, С.К. Йоргенсен и Г.Б. Кауфман, Многогранник , 2, 1983, 1-7.
: W.H. Брок, К.А. Дженсен, С.К. Йоргенсен и Г.Б. Кауфман, Многогранник , 2, 1983, 1-7. - Гилберт Т. Морган и Х.Д.К. Дрю, J. Chem. соц. , 1920, 117, 1456
- Х. Ирвинг и Р.Дж.П. Уильямс, Природа , 1948, 162, 746
- Описание жизни его Альфреда Вернера и влияния его работ на развитие координационной химии дано Г.Б. Кауфман в « Неорганические координационные соединения », Heyden & Son Ltd, 1981.
Проблемы
Рассчитайте изменение энтропии при 25°C для следующих реакций:
Zn 2+ + 2NH 3 <=> [Zn(NH 3 ) 2 ] 2+ 0 -28,03 кДж моль -1 и log 10 β 2 = 5,01 Zn 2+ + EN <=> [Zn (EN)] 2+ 7 ΔH = -27777.6.6.6.6.6.6.6.6.6.6.6.6.6.6.6.6.6.6.6.6.6.6.6.6.6.6.6.6.6.6.6. -1
Решение
Расчеты Используйте уравнения:
ΔG ° = RTLNβ
ΔG ° = 2,303RTLOG 10 β
° β 33333333 ° β
° β
° β
° β
° ° ° ° ° ° 2 β
° β
° β
° °. рассчитать значения ΔG по заданным константам пласта и температуре 25C = 298K.
рассчитать значения ΔG по заданным константам пласта и температуре 25C = 298K.
Для аммиачного комплекса ΔG = -8,314 * 298 * 2,303 * 5,01 кДжмоль -1 , то есть -28,6 кДжмоль -1 .
Для комплекса 1,2-диаминоэтана ΔG= -8,314 * 298 * 2,303 * 6,15 кДжмоль -1 , что соответствует -35,1 кДжмоль -1 .
Здесь используется соотношение между Ln и log10, так что ln(x) = 2,303 log10 (x).
Затем, используя второе вышеприведенное соотношение, можно найти ΔS.
\[\Delta S = \dfrac{\Delta H - \Delta G}{T}\]
Для аммиачного комплекса это дает 1,9 Дж-К -1 моль -1 и для 1,2- диаминоэтановый комплекс 25,2 JK -1 моль -1 , что является значениями, приведенными в ответе 2,
Авторы и ссылки
- Проф. Роберт Дж. Ланкашир (Химический факультет Вест-Индского университета)
Эта страница под названием Chelation распространяется по незаявленной лицензии, автором, ремиксом и/или куратором которой является Роберт Дж.