Хлориды в воде из скважины
Что такое хлориды в воде
Природная вода содержит значительное количество примесей, начиная от растворенных металлов и их солей, заканчивая механическими включениями в виде ржавчины, песка, глины. Химический состав примесей огромен, среди них части встречаются соли соляной кислоты, которые влияют на общее количество хлоридов в воде.
Если вы заметили, что качество водопроводной снижено: образуется накипь на приборах и посуде, вода имеет неприятный вкус, то есть большая вероятность, что вода содержит хлориды. Также при обустройстве скважины очень важно, провести анализ воды, чтобы установить концентрацию примесей в ней. Концентрация хлоридов в воде сверхдопустимых норм опасна для здоровья человека, бытового и промышленного оборудования, поэтому важно уметь определить их присутствие и правильно очистить воду от них.
Откуда хлориды в воде
Хлориды в воде - это соли, полученные при взаимодействии соляной кислоты и катионов металла, имеющие высокую растворимость в воде. Самые распространенные хлориды - кальциевые, магниевые и натриевые. Происхождение хлоридов в воде обусловлено природными источниками. Данные соединения есть практически в каждом природном источнике воды - реках, озерах, скважинах, ручьях, колодцах.
Содержание хлоридов в озерах и реках колеблется от доли грамма до нескольких граммов на литр, в морях количество хлорид-ионов составляют 87% от массы всех анионов, поэтому уровень их концентрации в морях и подземных водах позволяет отнести их к перенасыщенным растворам и рассолам.
Появлению их в воде они обязаны грунтовым и артезианским водам, которые вымывают соединения их пластов земли, которые в свою очередь образовались в результате извержения вулканов. В состав магматических пород входят следующие минералы:
- содалит;
- хлорапатит;
- галит и другие.
Большое количество хлоридов в виде солей хлорида натрия (NaCl) содержится в морях и океанах. Средняя концентрация хлорид-иона в мировом океане - 19 г/л.
Избыток в воде солей хлоридов геологического происхождения в поверхностях водах явление достаточно редкое, поэтому присутствие хлоридов на уровне выше нормального является показателем бытового и промышленного загрязнения воды. Значительное количество хлоридов в воде, обусловленное природными явлениями, бывает в случаях:
- засоления почвы в результате подъема высокоминерализованных подземных вод;
- постоянного притока вод с последующим испарением жидкости.
Еще одна значительная причина повышенного содержание хлорид ионов в воде - деятельность человека. Удобрения, соль для растворения льда на дорогах, выбросы предприятий химической промышленности, свалки, сточные воды и отходы человеческой деятельности - все это способствует появлению и круговороту хлоридов в природе. В промышленных сточных водах могут содержаться различные соли, характер и оказываемое влияние которых зависит от производственного предприятия.
Из всех известных анионов хлориды обладают самой высокой способностью к миграции, которая объясняется высокой растворимостью, слабо выраженной способностью к сорбции и потреблению живыми организмами.
Повышенное содержание хлоридов в питьевой воде придает ей солоноватый привкус и оказывает негативное влияние на здоровье человека, также она не пригодна для хозяйственных и технических нужд.
Допустимое содержание хлоридов в природных водах
Содержание хлоридов в воде зависит от сезонности и уровня минерализации воды. Например, в водоемах северной части России норма хлоридов в воде не выше 10 мг/л, а для южных регионов характерно значение от 10 до 100 мг/л.
Речные и озерные водоемы считаются пресными водами, поэтому значение хлоридов в воде находится на уровне 10 мг/л. Если при анализе обнаружено их повышенное количество, значит, водоем загрязняется сточными водами.
Нормирование хлоридов в питьевой воде
Знание ПДК хлоридов в воде и уровня содержания анионов хлора определяют пригодность воды для питья, использования в сельском хозяйстве и на промышленных предприятиях.
Нормы воды по хлоридам для централизованных систем определены государственным стандартом СанПиН 2.1.4.1074-01. Так уровень хлоридов в централизованном водоснабжении не должен превышать 350 мг/л, однако, рекомендованная концентрация хлоридов в питьевой воде составляет 200 мг/л. Разница значений концентрации для поступающей в дома воды и пригодной к употреблению диктует пользователям необходимость установки специальных фильтров очистки воды. Для полива растений концентрация хлоридов должна находиться на уровне 50 - 300 мг/л в зависимости от типа растения, для водных объектов рыбохозяйственного назначения наличие хлоридов в воде не должно превышать 300 мг/дм3.
В бассейнах нормы содержания хлоридов в воде (ПДК) не должны быть больше 700 мг/л.
Чем опасны хлориды в воде для организма человека
Влияние на организм хлоридов в воде заметили еще в древности. Вода, содержащая хлориды, превышающие допустимые значения, негативно сказывается на здоровье. При использовании такой жидкости страдают слизистые оболочки, глаза, кожа и дыхательные пути.
Хлориды в воде вредны для здоровья. Употребляя воду с хлоридами, человек испытывает нарушение водно-солевого баланса и пищеварительного тракта, возникают отечности. Переизбыток солей хлора:
- вызывает нарушение функционирования мочеполовой системы;
- приводит к изменениям кровеносной системы;
- оказывает повышенную нагрузку на почки и сердце;
- повышает кровеносное давление;
- усугубляет течение сердечно-сосудистых заболеваний.
На что еще влияют хлориды в воде
Хлориды в воде наносят вред домашним и сельскохозяйственным животным, влияют на рост и развитие растений.
Агрессивное воздействие солей разрушает бытовые и промышленные приборы, в разы увеличивая интенсивность коррозии. Такая вода имеет повышенную жесткость, соли оседает на нагревательных приборах, образуя накипь, снижая теплопроводность устройств и утвари, и приводят к поломкам оборудования.
На промышленные и бытовые коммуникации влияние хлоридов в воде оказывается в виде:
- коррозии и появлении темных пятен на поверхностях труб и нержавеющих стальных раковинах и агрегатах;
- из-за образующегося осадка снижается теплоотдача батарей и увеличивается расход энергии на подогрев воды;
- точечной коррозии труб и котлов отопления, приводя к разрушению стенок;
- уменьшения межремонтных периодов, вызванных аварийными ситуациями.
Как определить наличие хлоридов в воде
Самый верный способ определения концентрации хлоридов в воде - сдача пробы в лабораторию. Для этого нужно вызвать на дом специалиста, либо отобрать пробу самостоятельно и привести в специализированную организацию для проведения анализа на хлориды в воде. При самостоятельной доставке воды важно не подвергать ее воздействию температур и солнечных лучей, достаточно пропустить воду в кране в течение 5-10 минут и тонкой струей набрать воду по стенкам в 1,5-2 л бутылку, предварительно очищенную и вымытую в этой же воде.
Были разработаны ГОСТы, регламентирующие, какие методы, оборудование и расчеты использовать для определения содержания хлоридов в воде.
Методики определения содержания хлоридов в питьевой воде описаны в ГОСТ 4245-72, и основываются они на процессе титрования, при котором к имеющемуся раствору (анализируемой воде) подмешивают определенное вещество до тех пор, пока не прекратится протекать химическая реакция. Титриметрическое определение хлоридов в воде позволяет вычислить количественное или массовое содержание ионов хлора.
Иные современные нормативные документы, которые регламентируют качество воды и способы ее контроля, допускают применение химических, физико-химических и физических методов анализа. Помимо титрования используются такие методы как:
- определение хлоридов в воде с дифенилкарбазоном.
- меркуриметрический метод определения хлоридов в воде.
- определение хлоридов в воде фотометрическим методом и т.д.
Обнаружение хлоридов в воде в домашних условиях
Исследование воды на хлориды можно провести самостоятельно. В быту сигналом для проведения анализа могут стать:
- солоноватый вкус воды, скорее всего, превышена концентрация хлоридов натрия;
- горьковатый вкус свидетельствует о повышенном содержании хлоридов кальция.
Вода, с повышенным содержанием хлоридов, оказывает негативное воздействие на здоровье человека, на качество работы бытовых устройств и систем коммуникации. Очень важно вовремя определить концентрации анионов хлоридов и установить подходящие устройства очистки.
Как убрать хлориды в питьевой воде
Чаще всего для очистки воды от хлоридов используют методы, основанные на сорбции, ионном обмене и обратном осмосе. Все эти способы используются в системах очистки, как на крупных промышленных предприятиях, так и в быту в фильтрующих устройствах для централизованной водопроводов и воды, поступающей из скважин. Подробнее об очистке воды от хлорид-ионов вы можете прочитать в статье "Как очистить воду от хлоридов".
diasel.ru
Удаление хлоридов из воды
Вода из центрального водоснабжения, а также из скважин и колодцев, не всегда является пригодной для питья по результатам лабораторных исследований. Часто в ней содержатся примеси: механические включения в виде песка, ржавчины, ила, растворенные минералы, ионы марганца, кальция, железа, а также хлориды. Все эти вещества наносят вред здоровью человека, бытовым и промышленным устройствам, поэтому важно своевременно выявить проблему, и исключить негативное влияние примесей.
Одна из частых проблем, с которой сталкиваются потребители воды, - растворенные хлориды. Возникает вопрос "Чем убрать хлориды из воды?". Давайте разбираться…
Чем обусловлено превышение хлоридов в воде
Хлориды - это соли соляной кислоты. Чаще всего в воде присутствуют хлориды натрия, кальция и магния. В силу своей химической природы эти соединения обладают хорошей растворимостью и практически полным отсутствием склонности к сорбции, их не поглощают подводные обитатели, также они склонны к постоянной миграции. Все эти факторы способствуют высокому содержанию хлоридов в воде.
В мировом океане содержание хлоридов достигает 87%, поэтому вода из морей и океанов абсолютно непригодна для употребления. В пресные водоемы хлориды попадают из подземных вод путем вымывания из пород, вулканических остатков. Не малое влияние оказывает жизнедеятельность человека - загрязнение сточными водами и промышленными выбросами является основным фактором снижения качества воды.
Подробнее о природе хлоридов, допустимых нормах их содержания и способах обнаружения вы можете прочитать в статье: "Что такое хлориды в воде".
Основные способы очистки воды от хлоридов
Существуют 4 основных метода удаления хлоридов из воды, однако, в силу химико-физических свойств эффективность данных методов разная. В промышленных и домашних условиях снижение повышенного содержания хлоридов в воде проводят следующими способами:
- Очистка хлоридов в воде с помощью сорбции;
- Ионные фильтры для воды от хлоридов;
- Озонирование;
- Установки обратного осмоса для очистки воды от хлоридов.
Однако, очень часто при превышении хлоридов в воде, повышена также минерализация воды. В этом случае, для очистки воды от минерализации, эффективным является только метод обратного осмоса.
Сорбция - первый метод удаления хлоридов из воды
В силу того, что сильнорастворимые и самые распространенные хлориды обладают низкой склонной к сорбции, данным способом можно очистить воду лишь от труднорастворимых веществ: хлорида серебра, хлорида меди, хлорида свинца и хлорида ртути.
Суть данного способа очистки воды от хлорид-ионов состоит в том, что поступающие вместе с жидкостью вещества задерживаются на фильтрующей поверхности сорбционных фильтров с повышенной поглощающей способностью. Чаще всего в роли сорбента используют активированный уголь. Еще одна особенность данного способа очистки воды от хлоридов - необходимость проведения предварительного обеззараживания воды: уголь способствует быстрому распространению и развитию колоний бактерий.
Данный метод очистки воды от хлоридов можно использовать в бытовых целях в совокупности с иными методами водоподготовки.
Как понизить содержание хлоридов в воде с помощью ионного обмена
Ионообменные фильтры для очистки от хлоридов в воде используются в промышленности и для частных домов. Сущность метода снижения хлоридов в воде состоит в том, что специальная смола при контакте с водой поглощает отрицательно заряженные ионы всех солей. На выходе образуются ионы металлов: натрия, кальция, магния. Процесс помогает снизить жесткость воды.
Реакция происходит в анионитовых фильтрах, с предварительно загруженным специальным составом из синтетических смол, которые заменяют собственные ионы на ионы жесткости воды.
Озонирование - химическая очистка воды от хлоридов
Озон - это сильный окислитель, под его влиянием хлориды превращаются в нерастворенные вещества, которые удаляются из воды путем механической фильтрации. Вдобавок при такой обработке происходит дезинфекция воды. Для осуществления процесса необходимы специальные системы для очистки воды от хлорида натрия.
Как правило, озонаторы используются в промышленности и на водоочистительных станциях ввиду высокой стоимости, а также опасности чистого озона для жизни человека, в быту такие устройства не используются. Промышленная очистка воды от хлоридов с помощью озона уходит в прошлое. На смену приходят методы очистки хлоридов в воде с помощью обратного осмоса.
Как удалить хлориды в воде с помощью обратного осмоса
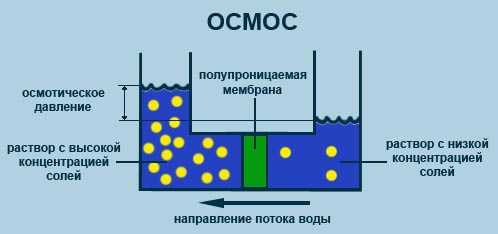
К наиболее прогрессивным и эффективным способам снижения высокой концентрации хлоридов в воде относят установки обратного осмоса. Обратный осмос - это физический процесс, позволяющий очистить воду от растворенных веществ и механических примесей. Этим методом удается снизить концентрацию хлоридов с порядка 40 г/л (фактически это опреснение морской воды) до норм, установленных СНиП.
Очистка воды от хлоридов обратным осмосом заключается в наличие полупроницаемой мембраны, которая беспрепятственно пропускает молекулы воды, при этом удерживая молекулы растворенных веществ. Этот процесс происходит под действием сил обратного осмоса. Когда со стороны раствора с высокой концентрацией подается внешнее давление, превышающее осмотическое, молекулы воды начинают двигаться в обратном от естественного направлении, то есть в отсек установки с наименьшей концентрацией воды. Обратный осмос - наиболее эффективное и выгодное решение, если в воде много хлоридов.
Очистка воды силами обратного осмоса относится к мембранным массообменным процессам с поперечным током, при котором поступающую в систему воду разделяют на два потока - пермеат (чистую воду) и концентрат (то, что остается после очистки).
Удаление хлоридов с воды осуществляется на мембранах обратного осмоса. Обратноосмотические мембраны бывают разных типов. Разработаны 3 основные модели:
- молекулярно-ситового разделения. Мембрана представляет собой "сито" с определенным размером отверстий. Качество очистки основывается на разном размере молекул у воды и солей. Однако соли хлорида натрия имеют схожую структуру с молекулами воды, поэтому данный тип мембран будет не очень эффективен для того, чтобы полностью очистить воду от хлорид-ионов;
- диффузионного переноса. Процесс очистки основывается на способности молекул к диффузии. Молекулы воды образуют водородные связи на поверхности мембраны и, образуя пленку, не дают солям пройти сквозь нее.
- капиллярно-фильтрационная. На поверхности и внутри, помещенной в раствор гидрофильной мембраны, образуется слой связанной воды, которая, образуя сетку из водородных связей, препятствует проникновению солей. Убрать хлориды из воды на этих мембранах можно до 98%.
Мембраны обратного осмоса полностью удаляют хлориды в воде
К полупроницаемым мембранам предъявляют высокие требования: способность пропускать воду и задерживать соли, иметь плотную структуру и высокое гидродинамическое сопротивление. Мембраны могут различаться по форме, по назначению, сырью, из которого изготавливаются, и способу их производства, по структуре, по величине заряда. Чаще всего изготавливаются асимметричные мембраны с плотным верхним слоем (толщиной до 1 мкм) и пористой нижележащей подложкой (толщиной 50-150 мкм). Удалить из воды хлориды можно как на производстве, так и дома. Важно отметить, что для бытового и промышленного использования применяются разные мембраны в зависимости скорости потока проходящей воды, ее состава и требований к чистоте получаемой жидкости.
К преимуществам обратноосмотического оборудования для очистки воды от хлоридов, помимо высокой степени очистки, можно также отнести низкую энергозатратность и высокий срок службы мембран.
Промышленные и бытовые установки обратного осмоса для очистки воды от хлоридов
Очистить воду от хлоридов можно на промышленных и бытовых установках обратного осмоса.
Давайте разберем, как удалить хлориды с воды на производстве. Основное направление промышленных установок обратного осмоса - обессоливание солоноватых вод и морской воды с целью получения питьевой воды, а также в качестве одной из ступени очистки жидкости для получения ультрачистой воды для медицины, теплоэнергетики и получения полупроводников.
Принципиальная схема промышленной установки обратного осмоса для удаления из воды хлоридов:
- тонкая очистка поступающей воды от механических примесей при помощи фильтров патронного или дискового типа;
- подача воды на насос высокого давления для создания достаточного давления среды для осуществления массообменного процесса;
- поступление воды в обратноосмотические модули, в которых размещены мембраны, где непосредственно происходит процесс снижения повышенной концентрации хлорида в воде.
- фильтры постобработки.
Промышленные фильтры для очистки воды от хлоридов могут работать в круглосуточном режиме, что очень удобно для предприятий с непрерывным циклом работы, а их производительность от 100 л/час и достигает 300 м3/ч.
Как убрать хлориды из воды на бытовых фильтрах обратного осмоса
Бытовые установки очистки хлоридов из воды не включают в себя насос. Для полноценного протекания процесса достаточно напора воды в водопроводе, однако, есть напора воды недостаточно, то установки комплектуются необходимым оборудованием. Также часто наблюдается превышение хлоридов в воде из скважины. Надежность и стабильность фильтров обратного осмоса от хлоридов в воде не дает сомневаться коммерческим и частным потребителям в правильности выбора данной системы для удаления примесей.
Мы знаем, как избавиться от хлоридов в питьевой воде
Очистные системы, имеющие в комплексе обратноосмотические мембраны, а также фильтры предварительной и посточистки, помогают избавиться не только от хлоридов в воде, но и ионов металлов, вредоносных микроорганизмов, хлора, механических включений.
Наши специалисты знают, как понизить хлориды в воде. Для достижения отличного результата, важно провести анализ воды и правильно подобрать комплектацию системы. В нашей компании вы можете купить уже готовую установку, а также заказать изготовление фильтров для воды от хлоридов под запросы конкретно вашего производства или частного дома. Просто оставьте заявку на нашем сайте или по телефону 8-499-391-39-59.
diasel.ru
Примеси хлоридов в питьевой воде
Обзор характеристик воды с повышенным содержанием хлоридов (натрия, кальция), их норм примесей, а также раскрытие вопроса вредного воздействия на живые организмы, бытовую технику и коммуникации.
Хлориды – это соли соляной кислоты. Магматические породы с хлорсодержащими минералами (хлорапатит, содалит и др.), а также соленосные отложения (галит) являются первичными источниками данного элемента.
Все природные воды содержат в своем составе хлориды, чаще всего встречающиеся в виде натриевых, магниевых и кальциевых солей. Их естественное содержание в грунтовых и артезианских водах обусловлено вулканическими выбросами, а также результатами кругового взаимодействия атмосферных осадков с почвами и обмена через атмосферу с океаном.
Основные характеристики хлоридосодержащих вод
Хлориды, содержащиеся в значительном количестве в воде, могут быть следствием вымывания хлористых соединений или поваренной соли из пластов, соприкасающихся с водой.
Воды подземных источников, некоторых озер и морей в большом количестве содержат хлорид натрия (NaCl), присутствующий в воде хлорид кальция (CaCb) придает ей некарбонатную жесткость.
При оценке санитарного состояния водоема учитывают показатель содержания хлоридов в воде. Так, к примеру, незначительное содержание отмечается в водах северной части России, обычно, не выше 10 мг/л, тогда как соответствующий показатель, характерный для южных регионов, доходит до 10-100 мг/л.
Прослеживается тенденция заметных сезонных колебаний концентрации хлорид-ионов в поверхностных водах, что связано с коррелирующим изменением общей минерализации. Это обусловлено критерием загрязнения водоема из-за попадания в него хозяйственно-бытовых стоков.
Высокое содержание хлоридов заметно ухудшает вкусовые качества воды, делает ее соленой на вкус, а также практически непригодной для хозяйственных и технических нужд, в том числе для оросительных работ на сельскохозяйственных угодьях.
Нормы примесей в воде
ПДК (предельно допустимая концентрация) хлоридов в воде не должна превышать 350 мг/л, в противном случае вода будет неприятной по вкусу – чрезмерно соленой.
Соленые (хлоридные) воды содержат соли хлоридной группы. Чаще всего катионный состав таких вод представляет натрий, образующий в сочетании с хлором поваренную соль, чем и обеспечен их соленый вкус. Причем, хлористый натрий заметно доминирует относительно других солей практически во всех хлоридных водах.
Хлористый магний преобладает в горько-соленых водах, где его все равно намного меньше, чем поваренной соли. Превышает количество растворенной поваренной соли в некоторых случаях содержащийся хлористый кальций в водах хлоридно-кальциевого типа.
Отличием от карбонатных и сульфатных ионов является их не предрасположенность к созданию ионных ассоциированных пар. Слабо выраженная сорбция с взвешенными веществами, легкая растворимость и потребление водными организмами объясняется хорошей миграционной способностью хлоридных анионов.
Вред воды с повышенным содержанием хлоридов для здоровья человека
При попадании в организм человека, а также домашних животных воды, содержащей избыточное количество хлоридов:
- раздражаются слизистые оболочки, глаза, кожные покровы, дыхательные пути;
- проявляется негативное воздействие на секреторную деятельность желудка;
- ухудшается пищеварение;
- нарушается водно-солевой баланс;
- возникает вероятность развития заболеваний системы кровообращения;
- появляется склонность к возникновению новообразований мочеполовых органов, органов пищеварения, желудка, пищевода;
- избыточное поступление в организм хлористого натрия увеличивает частоту сердечно сосудистых заболеваний;
- появляется склонность к гипертензивным состояниям, повышенной реактивности сосудов;
- возникает вероятность желче- и мочекаменных заболеваний.
Вред хлоридосодержащей воды для бытового оборудования
- Ввиду агрессивности воды с избыточным содержанием хлоридов увеличивается интенсивность коррозии металлических поверхностей бытовых приборов;
- появление осадка на нагревательных элементах стиральных и посудомоечных машин, электрических бойлеров, электрочайников приводит эти бытовые электроприборы к несвоевременному выходу из строя;
- поломка бытовых электроприборов увеличивает затраты средств на восстановительный ремонт или их полную замену, вследствие их дальнейшей непригодности.
Воздействие на коммуникации
- Коррозия и появление темных пятен на поверхности нержавеющих раковин;
- растворенные в избыточном количестве соли кальция и магния придают воде повышенную жесткость, которая способствует возникновению накипи (осадка) в трубах и на стенках отопительных котлов;
- ввиду меньшей теплопроводности накипи, по сравнению с металлом, из которого изготовлены трубы и нагревательные приборы происходит большая затрата энергии и времени на подогрев воды. Как следствие – недостаточно горячие батареи в помещениях;
- низкая теплоотдача служит причиной перегрева нагревательных элементов, на которых появляются деформации, трещины и вздутия, ведущие к поломке оборудования;
- точечная коррозия (очаги ржавчины) – еще одна причина, обусловленная накипью и приводящая к разрушению стенок котлов и труб;
- создание частых аварийных ситуаций, существенное сокращение сроков между плановыми ремонтами, увеличение затрат на обслуживание и ремонт – итоги проявления взаимодействия оборудования с водой, содержащей избыточное количество хлоридов.
Сохраните статью в соцсети:
Alex, 28 апреля 2016.Задайте свой вопрос по статье
sistemyochistkivody.ru
Очистка воды от хлоридов
 Достаточно часто в воде содержатся хлориды металлов или соли соляной кислоты. Часть из них в воде растворяется плохо, поэтому их легко удалить, другая часть имеет сильную степень растворимости, например:
Достаточно часто в воде содержатся хлориды металлов или соли соляной кислоты. Часть из них в воде растворяется плохо, поэтому их легко удалить, другая часть имеет сильную степень растворимости, например:
- AgCl, CuCl, HgCl2, TlCl и PbCl2 – малорастворимые
- NaCl (хлорид натрия), СаCl2 (хлорид кальция), MgCl2 (хлорид магния) – сильнорастворимые
Вода из любого природного источника содержит хлориды, которые попадают в нее естественным путем из грунта, содержащего соленосные отложения или хлорсодержащие минералы.
По СанПиН предельно допустимая концентрация (ПДК) хлоридов в воде – не более 350 мг/л. Стоит отметить, что на севере России природные водоемы обычно содержат хлоридов не более 10 мг/л, а в южных регионах их концентрация достигает 100 мг/л.
Задача очистки воды от хлоридов для частных лиц и для промышленности является первостепенной. При превышении концентрации вода становится чрезмерно соленой и жесткой и является причиной:
- Нарушений в работе организма людей и животных – раздражения слизистой оболочки, кожного покрова и дыхательных путей, возникновения разнообразных болезней желудочно-кишечного тракта, системы кровообращения и мочеполовых органов и множество других неприятных последствий;
- Выхода из строя бытового оборудования и промышленных коммуникаций – быстрое возникновение коррозии, солевых отложений (накипи).
Методы очистки воды от хлоридов
Хлориды из воды можно удалить несколькими способами:
- Озонирование – под воздействием озона, мощного окислителя, хлориды превращаются в нерастворимое состояние и удаляются из воды механической фильтрацией.
- Сорбция – очистка воды от хлоридов (труднорастворимых) путем задержания хлоридов фильтрующей поверхностью из активированного угля с повышенной поглощающей способностью. Стоит отметить необходимость предварительного обеззараживания воды, так как активированный уголь способствует быстрому развитию целых колоний микроорганизмов.
- Ионный обмен – очистка воды происходит благодаря загрузке из ионообменной смолы, которая быстро поглощает все отрицательно заряженные соли жесткости, в том числе и хлориды. Способ требует тщательного контроля и неприменим для бытового использования.
- Очистка воды от хлоридов обратноосмотическими установками является универсальной:
- Может применяться в домашних условиях и любом производстве,
- Степень очистки не зависит от состава исходной воды,
- Снижается не только уровень жесткости, но и содержание железа, цветности, запаха,
- Простая, надежная и длительная эксплуатация, компактные размеры. Очистка происходит за счет подачи воды на полунепроницаемые мембраны специфического физико-химического строения. Нежелательные примеси задерживаются мембраной, на выходе получается вода со степенью очистки до 96%.
Специалисты «Сибирской экологической компании» помогут подобрать оптимальное оборудование для очистки воды от хлоридов – любой проект разрабатывается только на основе предварительных анализов исходной воды. Работаем по всему Уралу, Сибири и Дальнему Востоку, а также в Казахстане.
www.sibecolog.ru
Превышение концентрации элементов в воде: ЧЕМ ГРОЗИТ?
14.05.2014 21:10В большинстве случаев, вода, которую мы потребляем, не соответствует нормам САНПиНа. Если у вас есть анализ воды со скважины или колодца и она содержит превышающие концентрации некоторых элементов, данная информация будет вам полезна!
О чем говорит избыток следующих веществ в воде, влияние на здоровье человека и оборудование:
Щелочность
Щелочность природных вод в силу их контакта с атмосферным воздухом и известняками, обусловлена, главным образом, содержанием в них гидрокарбонатов и карбонатов, которые вносят значительный вклад в минерализацию воды. Косвенный показатель жесткости.
Карбонаты и гидрокарбонаты
Карбонаты и гидрокарбонаты представляют собой компоненты, определяющие природную щелочность воды.
Сульфаты
Сульфаты в питьевой воде не оказывают токсического эффекта для человека, однако, ухудшают вкус воды: ощущение вкуса сульфатов возникает при их концентрации 250-400 мг/л. Сульфаты могут вызывать отложение осадков в трубопроводах при смешении двух вод с разным минеральным составом, например, сульфатных и кальциевых (в осадок выпадает СаSO4).
Хлориды
Если в воде присутствует хлорид натрия, она имеет соленый вкус уже при концентрациях 250 мг/л; в случае хлоридов кальция и магния соленость воды возникает при концентрациях свыше 1000 мг/л. Высокие концентрации хлоридов в питьевой воде не оказывают токсических эффектов на людей, хотя соленые воды очень коррозионно активны, пагубно влияют на рост растений.
Сухой остаток
Для питьевой и природной воды величина сухого остатка практически равна сумме массовых концентраций анионов (карбоната, гидрокарбоната, хлорида, сульфата) и катионов (кальция и магния, а также определяемых расчетным методом натрия и калия).
Общая жесткость, кальция и магний
Жесткость воды обусловлена присутствием солей кальция, магния, стронция и др. Содержание в питьевой воде кальция и магния играет важнейшую роль для человеческого организма. Кальций играет большую роль в жизнедеятельности клеток организма. Дефицит магния приводит к коронарной болезни сердца, с другой стороны, повышенное содержание магния угнетающе действует на нервную систему, поражая двигательные нервные окончания. Суммарная жесткость воды, т.е. общее содержание растворимых солей кальция и магния, получила название ―общей жесткости‖. При жесткости до 4 мг-экв/л вода считается мягкой; от 4 до 8 мг-экв/л – средней жесткости; от 8 до 12 мг-экв/л – жесткой; более 12 мг-экв/л – очень жесткой.
Нитраты
Повышенное содержание нитратов в воде может служить индикатором загрязнения водоема в результате распространения фекальных либо химических загрязнений (сельскохозяйственных, промышленных). Питьевая вода и продукты питания, содержащие повышенное количество нитратов, могут вызывать заболевания, и в первую очередь у младенцев (так называемая метгемоглобинемия).
Аммоний
Аммонийные соединения в больших количествах входят в состав минеральных и органических удобрений, кроме того, аммонийные соединения в значительных количествах присутствуют в нечистотах (фекалиях). По этим причинам повышенное содержание аммонийного азота в поверхностных водах обычно является признаком хозяйственно-фекальных загрязнений.
Нитриты
Нитрит-анионы являются промежуточными продуктами биологического разложения азотсодержащих органических соединений. Благодаря способности превращаться в нитраты, нитриты, как правило, отсутствуют в поверхностных водах.
Фтор (фториды)
Избыток фтора в организме вызывают разрушение зубной эмали, осаждает кальций, что приводит к нарушениям кальциевого и фосфорного обмена. По этим причинам определение фтора в питьевой воде, а также грунтовых водах (например, воде колодцев и артезианских скважин) и воде водоемов хозяйственно-питьевого назначения, является очень важным.
Железо общее
В природной воде железо содержится в виде соединений, в которых железо может быть двухвалентным или трехвалентным. В свою очередь, соединения железа могут образовывать истинные или коллоидные растворы. На воздухе железо двухвалентное быстро окисляется до железа трехвалентного, растворы которого имеют бурую окраску. Точные результаты могут быть получены только при определении суммарного железа во всех его формах, так называемого ―общего железа‖, хотя иногда возникает необходимость определить железо в его индивидуальных формах.
Медь
Медь является микроэлементом, содержится в организме человека, главным образом, в виде комплексных органических соединений и играет важную роль в процессах кроветворения. Отравление соединениями меди могут приводить к расстройствам нервной системы, нарушению функций печени и почек и др.
Цинк
Цинк является микроэлементом и входит с состав некоторых ферментов. Отрицательное воздействие соединений цинка может выражаться в ослаблении организма, повышенной заболеваемости, астмоподобных явлениях и др.
Кадмий
Соединения кадмия очень ядовиты. Действуют на многие системы организма –органы дыхания и желудочно-кишечный тракт, центральную и периферическую нервные системы.
Ртуть
Ртуть относится к ультрамикроэлементам и постоянно присутствует в организме, поступая с пищей. Соединения ртути вызывают глубокие нарушения функций центральной нервной системы, сердца, сосудов, нарушения в иммунобиологическом состоянии организма и другие
Свинец
Соединения свинца – яды, действующие на все живое, но вызывающие изменения особенно в нервной системе, крови и сосудах. Органические соединения свинца (тетраметилсвинец, тетраэтилсвинец) – сильные нервные яды, являются активными ингибиторами обменных процессов. Для всех соединений свинца характерно кумулятивное действие (накопление).
Активный хлор
В процессе водоподготовки в воду вводятся сильные окислители, содержащие хлор в разных степенях окисления: собственно, хлор (Сl2), гипохлорит-анион, хлорноватистая кислота, хлорамины. Суммарное содержание этих соединений в пересчете на хлор называют термином ―активный хлор‖. Активный хлор в указанных концентрациях присутствует в питьевой воде непродолжительное время (не более нескольких десятков минут) и удаляется даже при кратковременном кипячении воды.
Сероводород
Сероводород обладает резким неприятным запахом (тухлых яиц), вызывает коррозию металлических стенок труб, баков и котлов и является общеклеточным и каталитическим ядом. Соединяясь с железом образует черный осадок сернистого железа FeS (чёрные отложения в трубах и на арматуре, чёрное окрашивание вещей при замачивании вещей).
esc.msk.ru
Обзор. Химические показатели воды
Химический состав воды является причиной заболеваний неинфекционной природы.
Причины изменения химического состава воды:
1) промышленная и сельскохозяйственная деятельность человека- поступление производственных и бытовых сточных вод, атмосферных осадков, содержащих вредные вещества.
2) очистка питьевой воды - применение химических приемов обработки воды и содержание остаточных количеств реагентов в воде.
Показатели:
- сухой остаток
- жесткость
- хлориды
- сульфаты
- нитраты и нитриты
- значение рН
- микроэлементы
Сухой остаток
Сухой остаток-это общее содержание растворенных твердых веществ в воде, он дает представление о степени минерализации воды. Основными ионами, определяющими сухой остаток,, являются карбонаты, бикарбонаты, хлориды, сульфаты, нитраты, натрий, калий, кальций, магний. Данный показатель влияет на другие показатели качества питьевой воды, такие как привкус, жесткость, коррозирующие свойства и тенденция к накипеобразованию.
Воду с сухим остатком свыше 1000 мг/л называют минерализованной, до 1000 мг/л - пресной. Воду, содержащую до 50 - 100 мг/л, считают слабоминерализованной (дистиллированная),100 - 300 мг/л - удовлетворительно минерализованной, 300 - 500 мг/л - оптимальной минерализации и 500 - 1000 мг/л - повышенно минерализованной. Минерализованной водой является морская, минеральная, пресной - речная, дождевая, вода ледников.
Значение сухого остатка:
- Вода с повышенным содержанием минеральных солей непригодна для питья, так как имеет соленый или горько- солёный вкус, а её употребление в зависимости от состава солей приводит к неблагоприятным физиологическим изменениям в организме:
- способствует перегреву в жаркую погоду,
- ведет к нарушению утоления жажды,
- изменяет водно-солевой обмен за счёт увеличения гидрофильности тканей,
- усиливает моторную и секреторную желудка и кишечника.
- Слабоминерализованная вода неприятна на вкус, длительное её употребление может привести к нарушению водно-солевого обмена (уменьшение содержания хлоридов в тканях). Такая вода, как правило, содержит мало микроэлементов.
Жесткость
Общая жесткость воды обусловлена преимущественно присутствием в воде кальция и магния, которые находятся в виде гидрокарбонатов, карбонатов, хлоридов, сульфатов и других соединений; имеют также значение ионы стронция, железа, бария, марганца.
Виды жесткости:
- Устранимая - величина, на которую уменьшается общая жесткость воды при кипячении её в течении 1часа. Обусловлена гидрокарбонатами кальция и магния, которые разрушаются и выпадают в виде карбонатов в осадок (накипь).
- Карбонатная - это жесткость, обусловленная бикарбонатами и малорастворимыми карбонатами. Устранимая жесткость приблизительно равна карбонатной, но когда в воде много гидрокарбонатов натрия и кальция, карбонатная жесткость значительно превышает устранимую.
- Постоянная - это жесткость, которая остается после кипячения и обусловлена хлоридами, карбонатами, и сульфатами кальция и магния.
Воду с общей жесткостью до 3,5 мг-экв/л называют мягкой, 3,5-7 - средней жесткости, 7-10 - жесткой, свыше-10 - очень жесткой.
Основными природными источниками жесткости воды являются осадочные породы, фильтрация и сток с почвы. Жесткая вода образуется в районах с плотным пахотным слоем и известковыми образованиями. Для подземных вод характерна большая жесткость, чем для поверхностных. Подземные воды, богатые карбоновыми кислотами и растворенным кислородом, обладают высокой растворяющей способностью по отношению к почвам и породам, содержащим минералы кальцита, гипса и доломита.
Основными промышленными источниками жесткости являются стоки предприятий, производящих неорганические химические вещества, и горнодобывающая промышленность. Оксид кальция используется в строительной промышленности, производстве бумажной массы и бумаги, рафинировании сахара, в очистке нефти, дублении и как реагент для очистки воды и сточных вод. Сплавы магния применяются в литейном и штамповочном производстве, бытовых продуктах. Соли магния используются в производстве металлического магния, удобрений, керамики, взрывчатых веществ, медикаментов.
Значение жесткой воды:
- ухудшаются органолептические свойства - вода имеет неприятный вкус;
- нарушается всасывание жиров в кишечнике в результате образования кальциево-магнезиальных нерастворимых мыл при омылении жиров;
- у лиц с чувствительной кожей способствует появлению дерматитов в связи с тем, что кальциево-магнезиальные мыла обладают раздражающим действием
- в хозяйственно-бытовом аспекте: увеличивается расход моющих средств, образуется накипь при кипячении, волосы после мытья становятся жесткими, ткани одежды теряют мягкость и гибкость, ухудшается разваривание мяса и овощей с потерей витаминов в результате связывания их в неусвояемые комплексы,
- имеются данные, что употребление слишком жесткой воды может приводить к увеличению частоты мочекаменной болезни; хотя есть сведения о том, что жесткость может служить защитой от болезней;
- при резком переходе от пользования жесткой водой к мягкой и наоборот могут у людей наблюдаться диспептические явления;
- портит вид, вкус и качество чая, который является важнейшим напитком у населения, стимулирующим желудочную секрецию и утоляющим жажду;
Имеются данные о том, что употребление мягкой воды может явиться причиной сердечно-сосудистых заболеваний.
Хлориды
Хлориды могут быть минерального и органического происхождения. Присутствие хлоридов в природных водах может быть связано с растворением отложений солей, загрязнением, обусловливаемым нанесением соли на дороги с целью борьбы со снегом льдом, сбросом стоков предприятиями химической промышленности, эксплуатацией нефтяных скважин, сбросом сточных вод, ирригационным дренажом, загрязнением в результате вымывания твердых отбросов и вторжения морской воды в прибрежные районы. Каждый из этих источников может вызвать загрязнение поверхностных и подземных вод. Высокая растворимость хлоридов объясняет широкое распространение их во всех природных водах.
Влияние на здоровье. Хлориды - наиболее распространенные в организме человека анионы и играют большую роль в осмотической активности внеклеточной жидкости; 88% хлоридов в организме находятся во внеклеточном пространстве. У здоровых людей происходит почти полное всасывание хлоридов.
Значение хлоридов:
- ухудшаются органолептические свойства - вода приобретает солоноватый вкус и в связи с этим ограничивается водопотребление;
- влияет на водно - солевой обмен; повышается уровень хлоридов в крови, что приводит к снижению диуреза и перераспределению хлоридов в органах и тканях;
- вызывают угнетение желудочной секреции, в результате чего нарушается процесс переваривания пищи;
- имеются данные о том, что хлориды оказывают гипертензивный эффект и у людей, страдающих гипертонической болезнью употребление воды с повышенным содержанием хлоридов может вызвать утяжеление течения заболевания;
- являются показателем загрязнения подземных и поверхностных водоисточников, так как хлориды содержаться в сточных водах и физиологических выделениях человека.
Сульфаты
Сульфаты поступают в водную среду со сточными водами многих отраслей промышленности. Атмосферная двуокись серы (SO2), образующаяся при сгорании топлива и выделяющаяся в процессах обжига в металлургии, может вносить вклад в содержание сульфатов в поверхностных водах. Трехокись серы (SO3), образующаяся при окислении двуокиси серы, в сочетании с парами воды образуют серную кислоту, которая выпадает в виде «кислого дождя» или снега. Большинство сульфатов растворимы в воде.
С сульфатом алюминия, который используется в качестве флоккулянта при очистке воды, в очищенную воду может дополнительно попадать 20-50 мг/л сульфатов. Сульфаты не удаляются из воды обычными методами очистки. Концентрация в большинстве пресных вод очень низкая.
Значение сульфатов:
- сульфаты плохо всасываются из кишечника человека. Они медленно проникают через клеточные мембраны и быстро выводятся через почки. Сульфат магния действует как слабительное в концентрации выше 100 мг/л, приводя к очищению ЖКТ. Такой эффект возникает у людей, впервые использующих воду с высоким содержанием сульфатов (при переезде на новое место жительства, где употребляют сульфатную воду). Со временем человек адаптируется к такой концентрации сульфатов в воде.
- ограничивается водопотребление, так как сульфаты придают воде горько-соленый вкус в концентрации свыше 500 мг/л.
- неблагоприятно влияют на желудочную секрецию, приводя к нарушению процессов переваривания и всасывания пищи.
- являются показателем загрязнения поверхностных вод производственными сточными водами и подземных вод водами вышележащих водоносных горизонтов.
Нитраты, нитриты
Аммиак является начальным продуктом разложения органических азотосодержащих веществ. Поэтому наличие аммиака в воде может расцениваться как показатель опасного в эпидемическом отношении свежего загрязнения воды органическими веществами животного происхождения. В некоторых случаях наличие аммиака не указывает на недоброкачественность воды. Например: в глубоких подземных водах аммиак образуется за счет восстановления нитратов при отсутствии кислорода или повышенное содержание аммиака в болотистых и торфяных водах (аммиак растительного происхождения).
Соли азотистой кислоты (нитриты) представляют собой продукты неполного окисления аммиака под влиянием микроорганизмов в процессе нитрификации. Наличие нитритов свидетельствует о возможном загрязнении воды органическими веществами, однако нитриты указывают на известную давность загрязнения.
Соли азотной кислоты (нитраты) - конечные продукты минерализации органических веществ бактериями, присутствующими в почве и в воде с достаточным содержанием кислорода. Присутствие в воде нитратов без аммиака и нитритов указывает на завершение процесса минерализации.
Одновременное содержание в воде аммиака, нитритов и нитратов свидетельствует о незавершенности этого процесса и продолжающемся, опасном в эпидемическом отношении загрязнении воды. Однако повышенное содержание нитратов может иметь минеральное происхождение. Нитраты используют в качестве удобрений (селитра), во взрывчатых веществах, в химическом производстве и в качестве консервантов пищевых продуктов. Некоторые нитраты являются результатом фиксации в почве атмосферного азота (бактериальный синтез). Нитриты используют в качестве консервантов пищевых продуктов. Некоторые нитраты и нитриты образуются при вымывании дождем окислов азота, которые являются результатом разряда молнии или поступают из антропогенных источников.
Нитраты и нитриты широко распространены в окружающей среде, они обнаруживаются в большинстве пищевых продуктов, в атмосфере и во многих водных источниках. Поступлению этих ионов в воду способствует использование удобрений, гниение растительного и животного материала, бытовые стоки, удаление в почву осадка сточных вод, промышленные сбросы, вымывание из мест захоронения отходов и вымывание из атмосферы. В природных чистых водах нитратов, как правило, немного. Однако в грунтовых водах в пределах населенных пунктов, животноводческих ферм и в других местах, где почва длительно и массивнозагрязняется, содержание нитратов может быть высоким.
Поскольку ни один из обычно используемых методов очистки и обеззараживания воды не изменяет значительно уровня содержания нитратов, и поскольку концентрация нитратов заметно не изменяется в системе распределения воды, уровни содержания в водопроводной воде часто полностью аналогичны таковым для водных источников. Содержание нитритов в водопроводной воде ниже, чем в водных источниках, что вызвано их окислением в процессе очистки воды, особенно при хлорировании.
Метаболизм. Нитраты и нитриты легко поглощаются организмом. Нитраты поглощаются в верхних отделах тонкого кишечника, концентрируются преимущественно в слюне через посредство слюнных желез, выводятся через почки. Нитрат может легко превращаться в нитрит в результате бактериального восстановления. Восстановление нитратов в нитриты происходит во всем организме, включая желудок. Это превращениезависит от значения рН. У грудных детей, у которых кислотность в желудке в норме очень низкая, образуется большое количество нитрита. У взрослых кислотность в желудке характеризуется значением рН 1-5 и в меньшей степени происходит превращение нитрата в нитриты. Нитрит может окислять гемоглобин в метгемоглобин. При определенных условия нитриты могут реагировать в организме человека с вторичными и третичными аминами и амидами (пища) с образованием нитрозаминов, некоторые из которых считаются канцерогенами.
Значение нитратов, нитритов:
- вызывают развитие «водно-нитратнойметгемоглобинемии» за счет окисления нитритами гемоглобина в метгемоглобин. В основном данное заболевание возникает у детей. Чувствительность грудных детей к действию нитратов относили за счет их высокого поступления в организм относительно массы тела, присутствием нитрат редуцирующих бактерий в верхних отделах ЖКТ и более легким окислением эмбрионального гемоглобина. Кроме того, повышенная чувствительность наблюдается у грудных детей, страдающих нарушениями функции ЖКТ, при которых увеличивается количество бактерий, способных превращать нитраты в нитриты. Использование искусственных смесей для вскармливания детей тоже рассматривается как причина увеличения заболеваемости, так как вода, используемая для приготовления смеси может содержать повышенное количество нитратов. У грудных детей в желудке значение рН, близкое к нейтральному, способствует бактериальному росту в желудке и в верхних отделах кишечника. У детей отмечается недостаточность по двум специфическим ферментам, которые осуществляют обратное превращение метгемоглобина в гемоглобин. Длительное кипячение может усугублять проблему вследствие увеличения количества нитратов при испарении воды. Чаще причиной заболевания являлось использование в качестве источника воды частных колодцев с микробиологическим загрязнением (в них отсутствуют водоросли, активно потребляющие нитраты). Заболевание характеризуется развитием одышки, цианоза, тахикардии, судорог. У детей старше 1 года и взрослых заболевание в форме острого токсического цианоза не наблюдается, но возрастает содержание метгемоглобина в крови, что ухудшает транспорт кислорода к тканям - это проявляется слабостью, бледностью кожных покровов, повышенной утомляемостью.
- вызывают образование нитрозаминов, некоторые из них могут быть канцерогенами. Образование этих веществ происходит во рту или где-либо ещё в организме, где кислотность относительно низкая.
- являются показателем загрязнения воды органическими веществами.
Значение рН (активная реакция).
Кислыми являются болотистые воды, содержащие гуминовые вещества, щелочными - подземные воды, богатые бикарбонатами.
Значение:
- определяет природные свойства воды;
- является показателем загрязнения открытых водоемов при спуске в них кислых или щелочных производственных сточных вод;
- значение рН тесно связано с другими показателями качества питьевой воды. Рост железобактерий в большой степени зависит от рН. Они образуют в качестве конечного продукта метаболизма гидрат окиси железа, который придает красный цвет воде. При высоких значениях рН вода приобретает горький вкус.
- эффективность процессов коагуляции и обеззараживания зависит от рН. Обеззараживающее действие хлора в воде ниже при высоких значениях рН; это связано со снижением концентрации хлорноватистой кислоты.
www.maxmir-energy.ru
Очистка воды от хлоридов - BWT Group
Вода содержит в себе много разных растворенных химических веществ. Примеси, которые содержатся в грязной воде при регулярном попадании в человеческий организм приводят к развитию разных хронических заболеваний, а также уменьшают эксплуатацию бытовой техники.
К проблемам, которые связаны с качеством воды относятся: ржавые подтеки на приборах сантехники, коррозия металлических деталей, которые контактируют с водой, отопительные и водонагревательные системы и многое другое.
Решения BWT для промышленной и бытовой очистки воды:
Все эти проблемы означают, что следует очистить воду от хлоридов, а сделать это можно с помощью систем водоочистки и водоподготовки. По своему строению бытовые фильтры для очистки воды делятся на: картриджные, кувшинные и засыпные регенерируемые. Там, где небольшой расход воды, например, в загородных домах или в квартирах, подойдут картриджные фильтры, а там, где расход воды большой, подойдут регенерируемые.
Фильтры для очистки воды подбирают исходя из результатов анализа воды. Это могут быть: фильтры-умягчители, фильтры грубой очистки, фильтры-обезжелезиватели, сорбционные установки. При помощи фильтров грубой очистки из воды удаляются частицы и нерастворимые вещества – песок, ржавчина, взвеси. Фильтры для очистки воды от железа необходимы чтобы удалить или уменьшить в воде ионы марганца и железа. В таких фильтрах применяется метод обезжелезивания, который заключается в пропускании воды через наполнители-засыпки.
Для того, чтобы нейтрализовать присутствующие в воде ионы магния и кальция и избавить воду от жесткости, применяют фильтры умягчители. В воде данные ионы присутствуют в воде в форме сульфатов, хлоридов и карбонатов. Применение химического метода на основе засыпки из ионообменной смолы позволяет устранить жесткость.
Для того, чтобы очистить воду от хлоридов, используют сорбционные фильтры для очистки воды. С помощью фильтрации воды через засыпку активированного угля или других пористых материалов достигается необходимое качество воды. Для обеззараживания применяют ультрафиолетовые установки и обратноосмотические фильтры. При использовании установок ультрафиолетового обеззараживания в воде уничтожаются опасные микроорганизмы. Такие фильтры недорогие, но они не могут удалить из воды разные органические примеси, которые ухудшают ее вкус, цвет и запах, поэтому зачастую их используют при обработке больших объемов воды, например, для очистки и обеззараживания воды в бассейнах.
Очищение воды от хлоридов с помощью фильтров обратного осмоса позволяет снизить содержание хлоридов до границ, которые обозначены санитарными нормами. Данный метод очистки воды от хлоридов основан на приложении давления и предназначен для очистки воды в квартирах или в коттеджах. Принцип работы обратноосмотических фильтров следующий: при создании давления, которое противоположно осмотическому, скорость протекания раствора через мембраны уменьшается, при этом осмотическое давление равно тому давлению, которое следует сообщить раствору, для того чтобы привести его в равновесие с чистыми растворителями, от которого они отделены мембранами.
В процессе водоочистки от хлоридов вода проходит через полупроницаемую перегородку, при этом фильтрат скапливается по одну ее сторону, а хлориды остаются по другую. Обратноосмотические установки очищают воду от примесей почти на сто процентов, задерживая при этом даже вирусы. Такие фильтры применяют с целью получения воды для приготовления пищи, а также питьевой воды. Они обладают малой производительностью, кроме того, исходная вода уже должна пройти предварительную очистку.
Для того, чтобы правильно выбрать прибор для очистки воды от хлоридов, необходимо точно знать, какой именно расход воды предполагается в системе водоснабжения. Дело в том, что если, например, подать на фильтр тот расход, который окажется больше чем его пропускная способность, то вода будет проходить через него неочищенной. Устанавливать фильтры для очистки воды с большим запасом по расходу считается невыгодным из-за их высокой стоимости, поэтому следует учитывать, что сумма затрат может заметно вырасти даже при небольшом увеличении расхода.
Смотрите также:
www.bwt.ru
Хлориды, сульфаты | Очистка воды
Хлориды присутствуют практически во всех пресных поверхностных и грунтовых водах, а также в питьевой воде в виде солей металлов. Если в воде присутствует хлорид натрия, она имеет соленый вкус уже при концентрациях свыше 250 мг/л; в случае хлоридов кальция и магния соленость воды возникает при концентрациях свыше 1000 мг/л. Именно по органолептическому показателю – вкусу установлена ПДК для питьевой воды по хлоридам (350 мг/л), лимитирующим показателем вредности является органолептический.
Большие количества хлоридов могут образовываться в промышленных процессах концентрирования растворов, ионного обмена, высоливания и т.д., образуя сточные воды с высоким содержанием хлорид-аниона.
Высокие концентрации хлоридов в питьевой воде не оказывают токсического воздействия на человека, хотя соленые воды очень коррозионно активны по отношению к металлам, пагубно влияют на рост растений, вызывают засоление почв.
Сульфаты, как и хлориды, влияют на органолептические свойства воды. Они придают ей горький вкус. Пороговые концентрации по влиянию на вкус воды составляют для натрия, кальция и магния сульфата соответственно 500, 900 и 600 мг/л. Горький вкус становится ощутимым для большинства потребителей, если содержание сульфатов в воде превышает 500 мг/л. Кроме того, сульфаты в количестве 1—2 г оказывают слабительное действие. Также влияет вода, если содержит 700 мг/л магния сульфата. Однако со временем организм человека адаптируется к таким и даже более высоким концентрациям сульфатов в воде.
Чтобы питьевая вода не имела соленого или горького вкуса интенсивностью более 2 баллов, концентрация хлоридов не должна превышать 350 мг/л, а сульфатов — 500 мг/л, что и отражено в государственном стандарте на питьевую водопроводную воду. Кроме того, сульфаты и хлориды в питьевой водопроводной воде всегда содержатся одновременно. Поэтому они оказывают комбинированное воздействие на вкусовые рецепторы, результатом которого является усиление вкусовых ощущений. И если в отдельности хлориды в концентрации 350, а сульфаты —500 мг/л не ухудшают органолептических свойств воды, то присутствуя одновременно они придают ей ощутимый вкус интенсивностью свыше 2 баллов. Чтобы при этих условиях потребители не ощущали вкус, т. е., чтобы он не превышал 2 баллов, необходимо, чтобы сумма концентраций хлоридов и сульфатов, выраженная в долях от пороговых каждого вещества в отдельности, не превышала 1.
Рассказать друзьям
ochistkavodi.ru
Хлорирование воды деоксидом- Обзор +Видео
Хлорирование питьевой воды — как метод ее обеззараживания быстро набрал свою популярность и считался крупным достижением. На сегодня, подобный способ хоть и не является совершенным в абсолюте, однако, продолжает считаться одним из самых доступных и потому сохраняет свою востребованность.
Процедура хлорирования осуществляется практически во всех жилых районах нашей страны. Необходимость метода обусловлена тем, что в пресной воде, пусть даже и родниковой, содержится большое количество различных микроорганизмов, которые способны оказывать самое негативное, а порой и губительное влияние — на человеческий организм. Различного рода заболевания, которые могут передаваться от микроорганизмов живущих в открытой водной среде человеку, вирусы и т.д. От всего этого помогает защититься процедура хлорирования.
Общие сведения
В наше время существуют и другие способы очистки питьевой воды. Так, например, облучение помогает с наивысшей достоверностью очистить водную среду. На ряду с облучением, имеет место быть окисление и масштабное или местное кипячение.
Здесь важно понимать, что процедура окисления — абсолютна небезопасна и на смену проблем, которые могут принести микроорганизмы, могут прийти проблемы химического влияния на человеческий организм. Способ озонирования — современен и хорош по своей продуктивности, но и тут есть свои минусы. Дело в том, что озон не имеет свойства сохраняться в воде, а значит, что даже если очистка будет произведена успешно, по пути до водяных кранов жителей, она потеряет свою озоновую защиту и смысла от очистки попросту не будет. Облучение или же кипячение — не являются рациональными способами и подходят далеко не каждому случаю.
Разумно, что альтернативой вышеперечисленному будет именно — хлорирование питьевой воды.
Подробности
Прежде чем прибегать к помощи хлора, крайне важно правильно рассчитать дозировку. Если хлорирования будет недостаточно, то очень скоро воду снова начнут заселять вредоносные микробы, а если с дозировкой переборщить — это повлечет за собой отравление человеческого или животного организма.
Определить второе, при этом, значительно проще. При сверх избыточном содержании хлора, питьевая вода станет непригодна к употреблению. Поменяется вкус, запах, а так же сама по себе, жидкость станет жесткой.
ВАЖНО
Достаточной нормой окислителя в питьевой воде принято считать объем около 0,5 мг/л. Крайне важно тщательное размешивание реагента с обработанной водой. Контакт реакции должен продолжаться не менее полчаса, прежде чем питьевую воду можно будет готовить к употреблению. Гипохлорит натрия является надежным гарантом дезинфекции от всевозможных бактерий, патогенных организмов и вирусов. Кроме того, гипохлорит не токсичен, является абсолютом безопасности и не имеет взрывоопасных свойств.
Рассмотрим подробные преимущества и недостатки процедуры хлорирования:
К основным плюсам хлорирования относят:
- легкость хранения. Нет конкретных требований к хранению химикатов
- перевоз/перенос. Окислитель не нуждается в сложностях транспортировки
- высокая эффективность. Устойчив к различному типу загрязнений и является мощнейшим оружием в борьбе с большинством известных микроорганизмов
К минусам хлорирования можно отнести следующее:
- не противостоит против цист
- при значительном продолжении хранения, теряет свою активность
- при не соблюдении концентрации допустимой дозировки способен накапливать хлораты (раствор 9 рH на 450 mг/л)
Существует несколько технологий хлорирования воды. Рассмотрим инструкции по каждой, подробнее, ниже.
- Хлорирование хлорной известью. Достаточно распространенный метод дезинфекции водопроводов. Для транспортировки и хранения принято использовать деревянные и железобетонные баки, где внутренние поверхности в обязательном порядке облицованы цементом или кислотоупорной плиткой. При этом, активного хлора должно содержаться от 40 и выше процентов. При процессе хлорирования известью питьевой воды применяется двухпроцентный раствор. Это, примерно, пять кг извести на каждые сто литров. Если говорить о недостатках данного способа — затратность. Производство извести неэкономичная процедура, а кроме того, расход всегда повышенный.
СПРАВКА
Хлорная известь, на самом деле, относится к ядам. Получение этого вещества происходит при помощи воздействия газообразного хлора на сухую гашеную известь. Такие материалы как: свинец, резина и винипласт высоко устойчивы сами по себе и не подвергаются разъеданию известью.
- Хлорирование диоксидом хлора.
Этот способ имеет несколько своих преимуществ и отличается по своей производительности и эффективности процесса.
СПРАВКА
Производство хлора на генераторе хлора (производная реакции) выглядит следующим образом:
① Анод (окисление): 2Cl– → Cl2 + 2e– ② Катод (восстановление): 2h3O + 2e– → h3 + 2OH– ①+② (Объединёно) 2Cl– + 2h3O → Cl2 + h3 + 2OH–
Плюсы такого хлорирования:
- повышена органолептика
- жидкий хлор в особенной транспортировки не нуждается
- высокий уровень дезодорирующих и бактерицидных свойств
- хлорная органика в конечных продуктах обработки — отсутствует
- вкусовые качества воды, а также цвет и запах остаются неизменными
К минусам «диоксидового» хлорирования можно отнести:
- высокая стоимость диоксида
- имеются высокие риски взрывоопасности
СПРАВКА
Диоксид распространен в таблетированной форме.
- Дехлорирование.
Этот процесс происходит за счет очищения, путем введения в питьевую воду веществ, которые избавляют воду от избытка хлора. Такими веществами могут быть: сульфит, сернистый газ и гипосульфит натрия. Однако, с сульфитом натрия стоит быть осторожнее, ведь это вещество имеет свойство обволакивать воду, следовательно, заразить заново.
СОВЕТ
Отличным вариантом к дехлорированию станет — Угольный фильтр.
Уголь способен побороть неприятный вкус и запах после хлорирования, а так же убрать хлор и органические включения. Данное дехлорирование происходит при помощи химической реакции угольной поверхности с окислителем. По времени весь процесс занимает не более десяти минут, что дополняет удобства и простоты этому методу. Максимальной эффективности такого дехлорирования поможет добиться обратная промывка.
Итоги
Все эти способы хлорирования подходят для использования в домашних условиях. В квартире и для очистки колодца. Если произвести обработку правильно, соблюдая необходимые меры предосторожности, а так же взяв в расчет все преимущества и недостатки каждого из способа очистки, можно добиться нужного результата самостоятельно и без труда.
iseptick.ru
Хлорирование воды. Чем опасен хлор в воде. Методы удаления
Не для кого не секрет, что водопроводная вода несет с собой массу загрязнений. А ее низкое качество, негативно влияет не только на Ваше здоровье, а также на сантехнику. В этой статье Вы узнаете, чем опасен хлор в воде, можно ли купаться в хлорированной воде и какой вред она несет.
Подробнее о составе водопроводной воды читайте ЗДЕСЬ.
Чем обрабатывают воду в городах?

А как же обработка воды большими дозами хлора? Ведь пары хлора имеют специфику впитываться в организм через кожу! А учеными и врачами давно доказано, что постоянный длительный контакт вызывает ряд осложнений и болезней.
А как же обработка воды флокулянтами и аммиаком в предпаводковый период? Эти все химические вещества призваны обезопасить нас, но имеют обратную сторону, про которую Вам мало кто расскажет!
Грязная вода – опасность для детей!

А Ваши маленькие дети, когда купаются, они же не понимают, что эту воду пить нельзя не в коем случае, они это делают автоматически, ведь это «просто водичка». Многие современные доктора пишут, что хлор – главный убийца наших дней, который предотвращает одно заболевание, но тут же вызывает другое. Они связывают хлорирование воды с общим ухудшением здоровья людей.
Речь пойдет исключительно о хлоре, его пользе и вреде для человеческого организма. Для начала, давайте заглянем в прошлое и узнаем краткую историю появления этого вещества
История открытия вещества

В 1744 году шведский химик Карл Шееле, проводил опыты с соляной кислотой и почувствовал некий запах. Он очень был похож на аромат растворителя, в составе которого содержались соляная и азотная кислоты, которые способны растворять металлы. Ученый продолжил свои испытания и выделил из полученного вещества газ зелено-желтого цвета. В дальнейшем это подвигло его осуществить ряд экспериментов по воздействию этого газа на жидкости и газообразные вещества. Так родился хлорин, что в переводе с греческого – желто-зеленый.
Что же такое хлор?
Это макроэлемент, который необходим нашему организму. Получаем мы его с минеральными солями, кальцием, магнием, натрием, калием и другими микроэлементами. Самый примитивный источник хлорина – каменная соль. Оказывается, хлор находится не только в магазинах. Он присутствует в нашей крови, межклеточной жидкости, костях и коже. Хлор способен как поступать в организм, так и выводиться из него с продуктами распада – потом и мочой.
Зачем нужен хлор человеческому организму?
Есть такой процесс – кислотно- щелочной баланс. Вы не раз о нем слышали в рекламе, от врачей и так далее. Так вот, именно этот баланс в организме – это обмен, натрия, хлора и калия. То есть, эти элементы необходимы в межклеточной жидкости, костях и крови. Но самое важное, что их соотношение должны быть правильным. В противном случае, нарушение соотношения негативно влияет на самочувствие человека. Симптомы таких нарушений – отеки конечностей, работа сердца с перебоями, скачки давления в обе стороны.
Что такое процесс осморегуляции в организме?
Совокупность обменных процессов, в которых участвует хлор и другие необходимые макроэлементы – называют осморегуляцией. Благодаря этому «круговороту» в организме регулируется соотношение и концентрация полезных веществ, хорошо выводятся жидкости и соли, а также нормализуется артериальное давление. В связи с участием во многих обменных процессах, ученые называют хлор – осмотически активным элементом.
«После того, как началось хлорирование воды, началась и современная эпидемия сердечных болезней, рака и слабоумия» — констатирует доктор Прайс из клиники Сагино.
Последствия использования воды низкого качества
До 80% всех болезней в мире вызывает грязная вода низкого качества! Если вы употребляете некачественную воду, вы ускоряете процесс старения на треть! Это касается не только питьевого продукта, но даже того на котором Вы готовите еду.
Тем более сегодня доказано, что хлор убивает далеко не все вредные микроорганизмы. Они попадают в Ваш организм и отравляют организм токсинами. Совокупность всех этих негативных факторов способна вызвать нарушения на генетическом уровне!
Также существуют медицинские доказательства того, что опухоли почек и рак печени в 2% случаев возникают из-за повышенных концентраций хлора в воде. Это небольшой процент, но факты говорят за себя. А вот, что касается заболеваний иммунной системы, то здесь все 80% случаев. Если постоянно употреблять хлорированную воду в питьевых целях, то происходит неизбежное повреждение всех внутренних органов.
Многие люди до сих пор пьют водопроводную жидкость, некоторые «обеззараживают» ее кипячением, что не спасает ситуацию. А ведь при повышенных дозах хлоридов, которые организм получает из «питьевой» воды, чаще возникают такие заболевания, как пневмония и бронхит. Так как в первую очередь страдают дыхательные органы. Токсины, образующиеся в организме, делают свое дело медленно и уверенно.
Воздействие паров хлора на организм человека

Между прочим, пары хлора более опасны, чем водные растворы. Хорошо, что тенденция хлорирования постелей и одежды прекратилась. Раньше этот процесс широко использовался в быту. Пары хлора, которые человек вдыхает в повышенных концентрациях вызывают ожоги слизистой горла и пищевода. Особенно страдают люди, которые находятся в зоне риска. Это работники в химической промышленности, на вредных производствах, в сфере текстильной промышленности, также работа в сфере фармацевтики и производства целлюлозы. Заболевания органов в хронической форме не редкость среди этих людей. Некоторые специалисты в области изучения данного процесса считают, что влияние паров хлора на организм человека имеют серьезные последствия, особенно если это регулярно.
Естественные источники хлора

У человека есть суточная потребность в хлоре. Суточную дозу этого вещества (90%) организм получает из соли. В продуктах питания его мало, самое большое количество содержится в сыре и хлебе. Наибольшее количество хлора поступает в организм человека с водой, которая подвергается обработке. Если пить воду из крана и готовить на ней еду, может быть переизбыток. Что интересно, даже если не солить продукты, то Вы получите дозу данного вещества из обычных продуктов, благодаря современным технологиям производства.
Хлор есть в хлебе, сливочном масле, рыбе, твороге, грибах, молоке, кефире, яйцах, в кашах, картофеле, моркови, горохе, капусте и некоторых фруктах.
Какая необходимая суточная потребность хлора?
Для здорового человека при средней активности хватает 4000-6000 мл/сутки. В эти цифры необходимо учесть то количество хлора, которое содержится в приготовленной пище, воде и соли. Максимальная доза не должна превышать 7000 мл/сутки, это не принесет особого вреда, но при постоянных объемах в таком количестве наступит переизбыток. Большее потребление данного вещества необходимо людям, которые имеют болезни пищеварительного тракта и для активно занимающихся спортом.
Потребность в хлоридах для детей в возрасте до 3 месяцев – 300 мг/сутки, а до 18 лет – 2300мг/сутки.
Какие последствия при недостатке хлоридов в организме?
Недостаток грозит нарушением кислотно-щелочного баланса и обменом углеводов. При таких сбоях в организме возможно выпадение волос, разрушение зубов, старение кожи, обезвоживание, нарушение процесса мочеиспускания. Первые признаки такого состояния – сонливость, провалы в памяти, проблемы с концентрацией.
В институте нейробиологии Макса Планка, в 2012 году, в результате серии опытов выявили, что недостаток хлоридов в организме нарушает деятельность нервных клеток. А опыты на мышах показали, что перевозбуждение нервных клеток усугубляет эпилепсию.
Причины недостатка хлоридов в организме
Причиной нехватки хлора могут быть различные безсолевые или низкосолевые длительные диеты (более недели). Недостаток данного вещества усугубляет состояние человека если он страдает гипертонией или плохой работой почек. Другой причиной может быть принятие лекарственных препаратов без присмотра врача – стероидные гормоны, мочегонные препараты и слабительные. Они приводят к обезвоживанию, а резкая потеря хлора может очень негативно отразится на здоровье, вплоть до летального исхода.
Что происходит при купании в хлорированной воде?

Безобидное принятие горячего душа, в котором повышенная концентрации хлоридов опасней, чем употребление питьевой воды с хлором. Кожа самый большой орган в нашем теле, под воздействием горячей воды поры открываются и способны впитывать пары намного интенсивней. Исследования показали, что количество токсинов, попадающих в кровь при купании увеличиваются в 10 – 20 раз.
Как удалить хлор из воды?
Можно бросить в воду активированный уголь на 15 – 30 минут. Есть народный и не особо эффективный метод – кипячение воды и ее отстаивание в течении суток. Так как пары хлора имеют свойство испаряться. Но для купания такой метод никак не подойдет, поэтому есть более эффективные и удобные методы.
Вот по этим всем многочисленным причинам так популярны фильтры для очистки воды сегодня. Современные фильтрующие материалы и системы очистки позволяют максимально качественно и эффективно удалять любые примеси и вещества из воды. Начиная с простых механических фильтров, заканчивая отжимом чистейшего h3O из исходной жидкости.

Для удаления хлоридов используют угольные фильтры. Для бытового применения достаточно магистральных корпусных фильтров со сменным картриджем. Сменный элемент изготовлен из активированного кокосового угля и эффективно деактивирует хлориды. Такие фильтры подбираются в зависимости от суточного потребления и скорости отбора воды.
Удаление хлора в квартире компактными магистральными фильтрами

В квартирах устанавливают компактные магистральные фильтры типа Big Blue 10 или 20. Сменные картриджи делятся на два типа – засыпные с гранулированным кокосовым углем или спеченный брикет из спрессованного активированного угля. Брикетированные картриджи имеют большую площадь контакта сорбента с водой и задерживают механические примеси более 10 микрон. Эти компактные фильтры являются оптимальным решением также для домов или коттеджей. Помимо удаления хлора, они повышают органолептические свойства воды, удаляют мутность, различные запахи, пестициды, нефтепродукты, поверхностно активные вещества и органические соединения. Выбирать типоразмер необходимо в зависимости от количества санузлов и проживающих.
Удаление хлора в больших объемах потребления воды
При высоком потреблении воды устанавливают профессиональные угольные фильтры колонного типа, которые работают в автоматическом режиме под управлением управляющего электронного клапана. В таких фильтрах, наполнителем является угольная загрузка в гранулированном виде. Наполнитель обладает специальными свойствами для длительного использования и в автоматическом режиме промывается исходной водой. Существует множество угольных загрузок для разных целей, их выбор зависит от качества очищаемой воды, целей использования обрабатываемой жидкости и требуемого качества конечного продукта.
Активированные кокосовые угли нашли самое широкое применение. Любой бытовой фильтр, начиная с кувшинов, заканчивая многоступенчатыми профессиональными системами обратного осмоса не обходится без угольной очистки воды. В бытовом сегменте компактных фильтров это основной фильтрующий материал. Также его используют для очистки воздуха в автомобилях, бытовых системах, в коммерческом секторе, в промышленности.
Позаботьтесь о своем здоровье сейчас!
Если Вы живете в городе в многоэтажном доме, то выбор у Вас ограничен двумя пунктами – пользоваться водопроводной жидкостью низкого качества в ее исходном виде или установить фильтры для ее очистки. Благодаря развитию, насыщению рынка товарами, очистка воды в пределах квартиры доступна абсолютно каждому. С учетом того, что улучшения качества воды невозможно в ближайшие десятилетия по очевидным факторам, фильтры стали необходимым атрибутом в быту для каждой семьи, которая беспокоится за свое здоровье. Для того, чтоб получить из крана достойный продукт, необходимо полная замена водопроводов от источника до конечного потребителя. Чтоб этот новый водопровод оставался в пригодном состоянии, нужно дорогостоящее очистное оборудование, со своевременным обслуживанием и фильтрующими материалами надлежащего качества.
Компания Water-Service — ваш надежный партнер по очистке воды!

water-service.com.ua
Определение хлоридов в сточных водах (стр. 1 из 2)
Летняя практика по химии
Лицей № 8
Реферат
Тема:
« Определение хлоридов в водах»
Исполнитель:
Жидкова Люба
Руководитель:
Громова Н. Г.
Вульфсон Н. Д.
Сосновый Бор
1999 год.
ВВЕДЕНИЕ
Хлориды относятся к главным ионам, содержание которых в речных и озерных водах колеблется от доли миллиграммов до граммов в литре; в морских и подземных водах концентрация хлоридов выше – до перенасыщенных растворов и рассолов.
Основными источниками поступления хлоридов в водные объекты является соленосные отложения, магматические породы, в состав которых входят хлорсодержащие минералы (хлорапатит, содомит и др.), вулканические выбросы, засоленные почвы, из которых они вымываются атмосферными осадками. Гораздо большее количество хлоридов попадает в воду с промышленными и хозяйственными сточными водами.
Хлориды в воде не склонны к образованию ионных пар. Они обладают высокой миграционной способностью, что обусловлено хорошей растворимостью их в воде, слабо выраженные способностью к сорбции взвесями и донными отложениями и практическим отсутствием накопления водными организмами.
Повышенные концентрации хлоридов ухудшают вкусовые качества воды делая её непригодной для питьевого водоснабжения, а так же уменьшает или полностью исключает возможность использования для технических и хозяйственных целей, и орошение сельскохозяйственных территорий. Для водных объектов рыбохозяйственного назначения предельно допустимая концентрация (ПДК) хлоридов – 300 мг/дм3, для объектов хозяйственно- питьевого и культурно бытового назначения ПДК – 350 мг/дм3.
Хлориды относятся к устойчивым компонентам водной среды; пробы предназначенные для определения хлоридов не консервируют.
Перед выполнением определения хлоридов в пробе воды неизвестного состава следует провести качественную оценку их содержания. Для этого в 5 см3 анализируемой воды добавляют 3 капли 10% раствора AgNO3и перемешивают. О содержании хлоридов судят по интенсивности помутнения пробы (таблица 1).
В зависимости от предполагаемого содержания хлоридов выбирают методику анализа и объёма анализируемой пробы (таблица 1).
Таблица 1.
Качественная оценка содержания хлоридов в воде и рекомендуемый для тестирования объём пробы воды.
2. Метод определения.
Определение основано на образовании трудно растворимого осадка хлорида серебра при прибавлении раствора нитрата серебра к анализируемой воде. После полного осаждения хлоридов избыток ионов серебра реагирует с индикатором- хроматом калия- с образованием красновато- оранжевого осадка хромата серебра. Тестирование проводят в нейтральной или слабо щелочной среде (рН 7-10), поскольку в кислой среде не образуется хромат серебра, а в сильно щелочной возможно образование оксида серебра Ag2o. Мешающее влияние на определение хлоридов могут оказать: высокая цветность, мутность, сероводород и сульфиды, сульфиты, тиосульфаты, цианиды, карбонаты (более 100 мг/дм3), фосфаты (более 25 мг/дм3), аммиак (более 5 мг/дм3). Точному нахождению точки эквивалентности мешает также высокие (более 10 мг/дм3) концентрации металлов- свинца, железа и др.
Устранить или значительно уменьшить влияние всех мешающих веществ при высоком содержании хлоридов можно путем разбавлением пробы; если же содержание хлоридов невелико ( что маловероятно для загрязненных вод), для устранения мешающего влияния следует применить специальные приемы.
Мутность устраняют фильтрованием пробы, цветность – пропусканием пробы через колонку с активированным углем или сорбцией на гидроксиде алюминия.
3.Вычисление результатов определений.
Массовую концентрацию хлоридов в анализируемой воде находят по формулам:
илигде Сх или Схэ – массовая концентрация хлоридов в воде, мг/дм3 или моль/дм3 эквивалента соответственно.
V- объем раствора нитрата серебра, израсходованного на тестирование анализируемой пробы, см3;
V хол –объема раствора нитрата серебра израсходованного на тестирование пробы, см3.
С – концентрация раствора нитрата серебра, моль/дм3 эквивалента.
V1- объем пробы воды, взятой для тестирования, см3.
Cx=
ПДК сол.Н2О=11000
4.Требования безопасности.
1. При выполнении определений массовой концентрации хлоридов в пробах природных и очищенных сточных вод соблюдают требования безопасности, установленные в «Правилах по технике безопасности при производстве наблюдений и работ на сети Госкомгидромета», А., Гидрометеоиздат, 1983 год, или в «Инструкции по технике безопасности для гидрохимических лабораторий органив по регулированию и охране вод» М., 1975.
2. По степени воздействия на организм вредные вещества, используемые при выполнении определений, относятся к 2, 3, 4 классом опасности по ГОСТ 12.1.007.
3. Содержание используемых вредных веществ в воздухе рабочей зоны не должно превышать предельно допустимых концентраций в соответствии с ГОСТ 12.1.005.
4.Аппаратура и реактивы.
1. Реактивы:
А) вода дистилированная по ГОСТ 6709
Б) хромат калия по ГОСТ 4459, ч. д. а
В) нитрат серебра по ГОСТ 1277, ч. д. а.
2. Аппаратура:
А) воронка лабораторная по ГОСТ 25336
Б) колбы мерные не ниже второго класса точность по ГОСТ 1770
Вместимостью 50 см3 2
В) бюретка не ниже второго класса точности по ГОСТ 20292
вместимостью 25 см3 –1
Г) пипетка с одной отметкой не ниже 2 класса точность по ГОСТ 20292
вместимостью 5 см3 –1
Д) пипетка градуированная не ниже второго класса точности по ГОСТ 20292
вместимостью 1 см3 –2
Е) колбы конические по ГОСТ 25336
вместимостью 250 см3 –2
5.Отбор и хранение проб.
Отбор проб производится в соответствии с ГОСТ 171.5.05. Пробы помещают в стеклянную или полиэтиленовую посуду. Перед определением фильтруют через мембранный фильтр 0,45 мкм, очищенной кипячением в дистиллированной воде. Допустимо использование бумажных фильтров «синяя лента». При фильтровании через любой фильтр первые порции фильтрации следует отбросить.
Хлориды являются одним из наиболее устойчивых компонентов, поэтому определение модно проводить после выполнения анализа менее устойчивых соединений. Пробы не консервируют, хранят при комнатной температуре.
6.Приготовление растворов и реактивов.
1. Раствор хромата калия, 10% 50г K2CrO4взвешивают на технических весах, растворяют в 150 см3 дистилированной воды, добавляют для удаления хлоридов 10% раствор AgNO3 до появления слабого красновато-ораньжевого осадка, дают отстоятся в течении суток и затем фильтруют через фильтр “белая лента”. К фильтрованному раствору добавляют 300 см3 дистилированной воды и перемешивают. Хранят в склянке из темного стекла 3 мес.
2. Рабочий раствор нитрата серебра с концентрацией эквивалента 0,05 моль/дм3.
8,49 г AgNO3растворяют в дистиллированой воде в мерной колбе вместимостью 1 дм3 , доводят до метки и перемешивают. При наличии мути раствор отстаивают в течении нескольких дней и затем сифонируют прозрачную жидкость. Хранят в склянке из темного стекла.
Точную концентрацию раствора определяют тестированием стандартного раствора хлорида натрия не реже 1 раза в месяц.
7.Определение точной концентрации.
Для определения точной концентрации рабочего раствора нитрата серебра с концентрацией 0,05 моль/дм3 эквивалента в коническую колбу вместимостью 250 см3 помещают пипеткой 10 см3 стандартного раствора хлорида натрия, добавляют 90 см3 дистилированной воды и 1 см3 раствора хромата калия. Тщательно перемешивают и титруют раствором нитрата серебра с концентрацией эквивалента 0,05 моль/дм3 до появления красновато-ораньжевого осадка. Титрование повторяют 2-3 раза и при хлориде натрия, добавляют 90 см3 дистиллированной воды и 1 см3 раствора хромата калия. Тщательно перемешивают и титруют раствором нитрата серебра с концентрацией эквивалента 0,05 моль/дм3 до появлениякрасновато-ораньжевого осадка. Титрование повторяют 2-3 раза и при отсутствии расхожденя в объемах растворов AgNO3более 0,05 см3 за результат принимают среднюю величину. Одновременно выполняют холостое определение , использую для титрования 100 см3 дистиллированной воды.
Список используемой литературы.
1. Руководящий документ « Методические указания. Аргентометрическое определение хлоридов в водах».
2. А. П. Крешков «Основы аналитической химии»
mirznanii.com