Сульфиды в воде из скважины
Сульфаты и хлориды в воде
Из-за способности к растворению минералов и органики вода никогда не встречается в природе в химически чистом виде. Она содержит различные механические примеси, взвешенные частицы и ионы. Некоторые растворенные минеральные вещества изменяют органолептические показатели воды: вкус, цветность, запах. Благодаря этому их легко обнаружить, а иногда и идентифицировать даже без специализированных лабораторных тестов. Хлориды и сульфаты в воде относятся к наиболее распространенным примесям. В разных концентрациях и соотношениях они содержатся во всех природных источниках: в открытых и подземных водоемах. Поэтому удаление хлоридов и сульфатов из воды является одной из важных стадий водоподготовки.
Откуда сульфаты и хлориды в воде
Большинство солей соляной кислоты имеет хорошую растворимость. Во всех природных водах содержится хлорид натрия - поваренная соль. В наиболее высоких концентрациях NaCl содержится в морях, океанах и внутриконтинентальных соленых озерах, при взаимодействии с атмосферой он попадает и в пресные источники. В артезианские воды анионы соляной кислоты попадают в результате вулканических выбросов.
Сульфат магния и хлорид натрия попадают в поверхностные водоемы из городских ливневых стоков: они содержатся в большинстве противогололедных реагентов.
Сульфаты - соли серной кислоты - попадают в воду также из серосодержащих осадочных горных пород, а также в процессе окисления серы и сульфидов магматического происхождения. Выветривание и вымывание водой играют в этом важную роль. Наиболее высокое содержание сульфатов наблюдается в гипсе, а также его волокнистой и зернистой формах - селените и асбесте. По химическому составу минерал представляет собой гидрат сульфата кальция (CaSO4×2h3O). Сернокислые анионы попадают в воду в результате отмирания растительных и животных тканей.
Некоторые виды бактерий восстанавливают сульфаты до сероводорода, который затем превращается в сульфиды и под действием кислорода, попадающего в воду, вновь окисляется до сульфатов.
Повышенное содержание хлоридов и сульфатов в воде может быть результатом деятельности промышленности. Стоки химических, коксохимических предприятий, производства минеральных удобрений выносят их в поверхностные водоемы.
Влияние хлоридов и сульфатов на качество воды
Хлориды и сульфаты в питьевой воде можно определить даже без химического анализа. Вкус - один из главных органолептических показателей воды. Хлорид натрия в концентрации выше 250 мг/дм3 и хлорид магния (1000 мг/дм3) делает ее соленой, а сульфаты при содержании более 500 мг/дм3 дают заметную горечь. Если вода используется для приготовления пищи или напитков, содержание и соотношение этих анионов снижает их качество.
В соответствии с положениями СанПиН, питьевой воде общее содержание хлоридов не должно превышать 350 мг/дм3, а сульфатов - 500 мг/дм3. В противном случае интенсивность вкуса будет превышать 2 балла.
При употреблении питьевой воды, в которое наличие сульфатов и хлоридов превышает нормы, нарушается водно-солевой баланс, угнетается желудочная секреция. Увеличенная концентрация сульфатов может давать слабительный эффект, однако человеческий организм со временем адаптируется и перестает реагировать на них.
Сульфаты и хлориды кальция в природных водах - основные источники постоянной жесткости воды. Они отличаются ограниченной растворимостью. При повышении температуры и/или концентрации эти вещества образуют твердую накипь, которую сложно удалить. Отложения на стенках котловых теплообменников и в системах охлаждения значительно сокращают КПД и срок службы оборудования.
Определение сульфатов и хлоридов в воде
Первый признак наличия сульфатов, хлоридов и фосфатов в воде - изменение ее вкусовых качеств. Такой способ позволяет судить об их наличии, но не дает возможности судить о концентрациях. Чтобы определить качественный состав воды, в специализированных лабораториях делают анализ воды на хлориды и сульфаты.
Стоит отметить, что значение хлоридов и сульфатов в воде из большинства источников непостоянно, и его колебания носят сезонный характер. Это связано с деятельностью бактерий, участвующих в круговороте серы. Измерение хлоридов и сульфатов в воде должно проводиться на специальном оборудовании в аккредитованной лаборатории.
Как очистить воду от сульфатов и хлоридов
Убрать сульфаты и хлориды из воды можно двумя способами: ионным обменом и обратным осмосом.
Ионообменные смолы, имеющие реакцию сильного основания дают высокую степень очистки от сернокислых анионов. При прохождении через анионит сульфаты связываются в нем и замещаются одновалентными ионами. У такого способа есть ряд недостатков:
- необходимость постоянного контроля воды на входе и выходе из фильтра;
- высокая вероятность выброса сульфатного концентрата в очищенную воду;
- высокая стоимость очистных установок;
- необходимость дополнительного умягчения.
Из-за этого ионный обмен используется только в промышленной водоподготовке на крупных предприятиях. Этот метод не подходит для удаления солей соляной кислоты - хлоридов.
Как убрать из воды хлориды и сульфаты обратным осмосом
Обратный осмос - самый эффективный способ очистки питьевой воды от хлоридов и сульфатов. Технология позволяет почти на 100 % удалять растворенные минеральные соли. Обратный осмос - это прохождение раствора под давлением через полупроницаемую мембрану. Она свободно пропускает молекулы воды и задерживает все растворенные примеси. Важное преимущество обратного осмоса - универсальность. Он удаляет не только сульфаты и хлориды, но и другие ионы, не пропускает бактерии, вирусы, тяжелые металлы.
На рынке оборудования для водоподготовки представлено два класса установок обратного осмоса:
- Промышленные установки для предприятия или дома. Промышленные системы обратного осмоса устанавливают в местах врезки в магистральный трубопровод.
- Бытовые фильтры для квартиры. Компактные моноблочные фильтры обратного осмоса чаще всего размещают под мойкой на кухне.
Мы поможем вас очистить воду от сульфатов и хлоридов
Обратный осмос отличается высокой степенью автономности, то есть не требует постоянного внимания. Важно правильно определить потребности в очищенной воде, подобрать фильтры предподготовки и выполнить первоначальную настройку системы. В этом вам помогут сотрудники нашей компании. Мы осуществляем продажу обратноосмотических фильтров бытового и промышленного классов, а также оказываем полный спектр сопутствующих услуг по очистке воды от сульфатов и хлоридов: помогаем с выбором конфигурации и схемы монтажа, поставляем оборудование, выполняем обслуживание и ремонт. За консультациями вы можете обратиться через обратную связь или по телефону 8-499-391-39-59.
diasel.ru
Сероводород в воде: норма, как определить и чем опасен

3 октября 2018 / 2961 просмотров
Заподозрить наличие сероводорода в воде достаточно просто. Он придаёт ей характерный и очень неприятный запах тухлых яиц. Согласитесь, что когда жидкость с таким «ароматом» течёт из крана – это повод «звонить в колокола». Такую ситуацию ни в коем случае нельзя пускать на самотёк. Чем опасен сероводород в воде, и как от него избавиться – узнаете из нашей статьи.
Сероводород в воде: норма
Сероводород в воде из скважины или из-под крана легко распознать по характерному запаху тухлых яиц. А если вы решитесь попробовать такую жидкость, то окажется, что она имеет неприятный сладковатый привкус. Сероводород – это очень токсичный газ, который даже в минимальных дозах способен серьёзно навредить здоровью человека. Поэтому строго контролируется такой показатель как сероводород в воде. Норма этого вещества, согласно Государственным санитарным нормам не должна превышать 0,03 мг/л.
Откуда берётся вода с повышенным содержанием сероводорода?
- сточные воды из населённых пунктов
- стоки предприятий
- попадание внутрь скважины биологических объектов (гниение)
- заиливание дна и стенок труб (в скважинах)
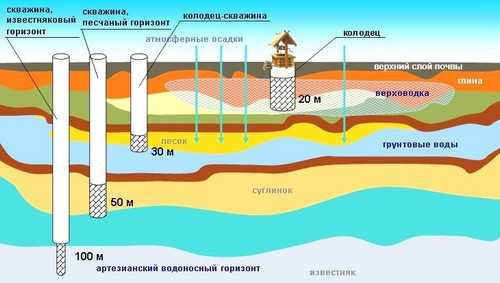
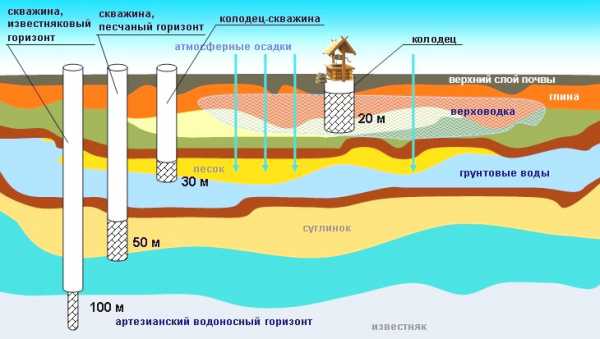
Очень часто сероводород в воде обнаруживается в глубоких скважинах, поскольку там минимальный доступ кислорода. А вот неглубокие колодцы в зоне риска во время таяния снега и сильных дождей: тогда в грунт просачивается органика и без доступа воздуха начинают размножаться бактерии.
Неприятный запах, по которому сразу можно определить наличие сероводорода в воде, появляется вследствие жизнедеятельности анаэробных бактерий. Они превращают соединения серы (сульфаты и сульфиды) в сероводород. Идеальные условия для размножения этих бактерий – бескислородная среда. Кроме того, превышение показателей сероводорода в воде из скважины или колодца свидетельствует о том, что там активно идут процессы гниения и нужно принимать срочные меры по очистке.

В чём опасность воды с содержанием сероводорода?
Вода, в которой превышено содержание сероводорода является крайне токсичной. Поскольку это вещество оказывает негативное воздействие на весь организм: разрушает клетки крови, мозга. Симптому отравления сероводородом:
- головные боли
- тошнота, рвота
- кожные заболевания
- отёк лёгких
- при сильном превышении допустимых концентраций появляются судороги, пострадавший может впасть в кому
Возможен даже летальный исход.
Вода с повышенным содержанием сероводорода способна привести в негодность всю систему водоснабжения, так как сероводород вызывает сильнейшую коррозию металлов. В соединении с железом он образует осадок сернистого железа, трубы очень быстро забиваются.
Анализ воды на сероводород
Как определить сероводород в воде, чтобы знать, насколько превышена норма и что делать в такой ситуации? Надёжнее всего сдать воду на анализ в лабораторию. Для получения достоверных результатов важно правильно отобрать пробы.
- вода набирается в тщательно вымытую тару
- перед забором пробы воду из крана нужно сливать 10 – 15 минут
- попасть «в работу» пробы должны не более чем через два часа после их забора.
Обратите внимание, что запах сероводорода в какой-то момент может перестать ощущаться, поскольку действует и на обоняние. Не обольщайтесь, что проблема решена. Сдайте воду на анализ и срочно принимайте меры.
Бывает, что характерный сероводородный запах появляется только после нагревания воды. Во-первых, при нагревании бактерии начинают активнее размножаться. А во-вторых, проблема может быть в самих нагревательных приборах (бактерии могут размножаться на стенках бойлера, нагревательных элементах и т.п.). Если бойлер работает не постоянно или не на полную мощность, то вода может застаиваться и создавать прекрасную среду для размножения бактерий.
Как избавится от сероводорода в воде?
После того, как результаты анализов подтвердили превышение концентрации сероводорода в воде, нужно исправлять ситуацию. Если сероводород обнаружился в воде из скважины, то стандартные действия следующие:
- очистка скважины (удаление ила на дне и стенках труб, удаление отложений и т.п.) Вообще такую чистку желательно проводить не реже, чем раз в два года.
- прокачка скважины
- удаление слоя глины и песка
- герметизация или замена труб
- чистка водонагревательных приборов (бойлеров)
Удаление самого сероводорода также проходит несколькими способами
- аэрация (насыщение воды кислородом, который окисляет сероводород в воде, бактерии при этом уничтожаются).
Минус этого метода в применении достаточно громоздких установок.
- очистка от сероводорода при помощи специальных реагентов-окислителей, нейтрализующих вредные вещества. Также можно применять угольные фильтры
После того, как приняты меры по очистке, нужно провести повторный анализ воды на сероводород, чтобы убедиться, что теперь она пригодна для питья и бытовых нужд.
У Вас есть вопросы или Вам нужна консультация?
Заполните форму и получите бесплатную консультацию!
Читайте похожие статьи:
himanaliz.ua
Определение сероводорода в воде - Анализ воды на сероводород
Сероводород - это газ, имеющий характерный неприятный запах (запах тухлых яиц).
Содержание данной примеси практически не меняет цвет воды, но придает ей сладковатый привкус. Воду с повышенным содержанием сероводорода нельзя употреблять в пищу.
Источники сероводорода в воде
- Инородные органические вещества, попадающие в грунт в период паводков и осадков
- Залежи сульфидных руд, растворяемые водой
- Сульфитные бактерии из почвы, проникающие в воду в результате потери герметичности скважины
Больше всего подвержены загрязнению сероводородом заброшенные колодцы, глубокие скважины с артезианской водой и водоносные пласты под грунтом.
Влияние сероводорода на здоровье человека и коммуникации
Сероводород – это токсичная примесь, которая может нанести огромный вред здоровью. Сероводород разрушает клетки, в том числе мозговые, в результате чего появляются негативные факторы в виде головных болей, тошноты, отравления и аллергических реакций. К особо тяжелым случаям относится отек легких, состояние комы и даже смерть. Очень часто возникает притупление рецепторов вкуса и обоняния.
Большое содержание сероводорода в воде отрицательно влияет на коммуникации и бытовую технику. Это проявляется в коррозии металлов, быстром износе деталей и приборов, уменьшении проходимости труб и снижении их срока эксплуатации.
Загрязненную сероводородом воду не стоит давать домашним животным и скоту, а разведение рыб в таких водоемах крайне нежелательно.
Допустимая концентрация сероводорода в воде
Содержание сероводорода в колодцах, скважинах и других источниках питьевой воды общего пользования не должно превышать 0,003 мг на литр. В противном случае источник нуждается в удалении сероводорода из воды.
Для того чтобы провести очистку воды от сероводорода, необходимо узнать степень его содержания. Для этого потребуется проведение химического анализа в лаборатории.
Условия отбора пробы на сероводород
Для того чтобы провести анализ на сероводород, необходимо правильно собрать материал:
- Взять в лаборатории тару, содержащую специальный концентрат – ацетат цинка
- Слить воду сильным напором в течение 5-10 минут
- Настроить напор тонкой струей
- Отобрать 1,5-2 литра исходной воды в полученную тару с консервантом
- Наполнить тару до краев, закрыть крушкой и "выдавить" весь воздух из тары
- В течение 24 часов доставить в лабораторию
Как убрать сероводород из воды
Что делать, если выявлено превышение в содержании сероводорода? Решение – установить систему водоочистки. Очистить воду от сероводорода можно тремя методами:
- Физическим – удаление 65-70% сероводорода с помощью аэраторов различных конструкций
- Химическим – очищение воды при помощи сильных окислителей
- Биохимическим – очищение воды путем окисления с использованием специальных бактерий
Лаборатория «ИОН» предоставляет услуги по проведению анализа воды. У нас вы сможете получить подробный отчет о состоянии вашей воды и рекомендации по улучшению ее качества. Мы работаем только с качественным и современным приборным парком, сотрудничаем с крупнейшими разработчиками аналитического оборудования и занимаемся поиском новых методов диагностики веществ и материалов. В нашей лаборатории вы сможете исследовать питьевую, природную, талую, морскую, технологическую воду, а также воду из бассейнов и мест общего пользования.
Все статьиТакже рекомендуем почитать

Железо в воде
Содержание железа в воде – распространенное явление. В допустимых приделах оно приносит пользу организму, но его избыток опасен как для сантехники, так и для человека. Появление железа в воде из скважины связано с процессами растворения горных пород.

Жесткость воды
Главная причина жесткой воды – наличие солей кальция и магния. Источники жесткости имеют исключительно природный характер, это единственная экологическая проблема, которой не присущ антропогенный фактор.
Цены на определение сероводорода в воде
* Бесплатный выезд для физических лиц в пределах МКАД при заказе на сумму более 5 000 ₽. Подробнее в разделе Доставка и оплата
ion-lab.ru
СЕРОВОДОРОД И СУЛЬФИДЫ - это... Что такое СЕРОВОДОРОД И СУЛЬФИДЫ?
СЕРОВОДОРОД И СУЛЬФИДЫ
см. СЕРА И ЕЕ СОЕДИНЕНИЯ
СЕРОВОДОРОД И СУЛЬФИДЫ (H2S, NaHS, NH4)2S, Fe2S3, PbS и др). Сероводород и сульфиды присутствуют в природных водах в небольших количествах и образуются при разложении органических веществ. Они содержатся в сточных водах коммунально-бытового хозяйства, металлургических, химических, целлюлозно-бумажных, кожевенных заводов в больших концентрациях.
В воде сульфиды находятся в трех формах: свободного сероводорода, гидросульфид-ионов (HS′) и сульфид-ионов (S″). Соотношение этих форм зависит от рН воды. При отклонении рН в кислую сторону содержание свободного сероводорода резко возрастает, а в щелочную — наоборот. Он придает воде запах тухлых яиц при концентрациях 0,001 — 0,05 мг/л.
Токсичность сернистых соединений обусловлена главным образом действием неионизированных молекул сероводорода, а также тем, что в его присутствии в водоеме возникает резкий дефицит кислорода. Поэтому обнаружить свободный сероводород в воде очень трудно. Смертельной концентрацией сероводорода и сульфида натрия является: для форели — 0,86 — 1, гольяна — 6, карпа — 3,3 — 6,3 мг/л (Belding, Я.М. Грушко). Минимальной смертельной концентрацией сероводорода для рыб считают 1,0 мг/л.
Сульфид натрия вызывает гибель леща, колюшки, кижуча, чавычи и молоди карпа в концентрациях 3,0 — 4,5 мг/л, а токсический эффект — 0,5 — 3 мг/л. При снижении рН воды от 7,8 до 6 его токсичность повышается в 2,5 раза, а от 8 до 5 — в 16 раз.
Частичная гибель дафний наступает при концентрации сероводорода — 1,0 мг/л, сульфида натрия — 10,0 мг/л, а хирономид — 70,0 и 1000,0 мг/л соответственно.
Симптомы и патоморфологические изменения. Сероводород — сильный нервный яд. Проникая в клетки, он связывается с железом и нарушает тканевое дыхание. На жаберный аппарат и кожу действует раздражающе.
При отравлении рыб сероводородом снижается частота и нарушается ритм дыхательных движений, уменьшается потребление кислорода, отмечаются расстройства координации движений и параличи. Смерть обычно наступает от остановки дыхания. Рыбы, перемещенные в чистую воду на стадии потери равновесия, быстро поправляются.
Патоморфологические изменения изучены недостаточно. Тело рыб обычно покрыто опалесцирующей слизью, внутренние органы кровенаполнены, эпителий жабр в состоянии некробиоза.
Диагноз устанавливают по внешним признакам интоксикации и результатам определения содержания сероводорода и сульфидов в воде с учетом величины рН и концентрации растворенного кислорода. Количество сероводорода и сульфидов в воде определяют колориметрическим или йодометрическим методом. При высоком содержании сероводорода в воде и теле рыб можно пользоваться качественной пробой со свинцовыми бумажками или органолептическим определением по запаху.
Профилактика заключается в недопущении заиления дна водоема, соблюдении рекомендуемых плотностей посадки рыб, особенно в период зимовки, регулярном летовании прудов, а также исключении загрязнения их сточными водами. Присутствие сероводорода в прудах не допускается. При обнаружении его в придонных слоях необходимо срочно увеличить водообмен, известковать кормовые места.
Болезни рыб: Справочник. - М.. Г. В. Васильков, Л. И. Грищенко, В. Г. Енгашев и др.; Под ред. В. С. Осетрова.. 1989.
fish_diseases.academic.ru
СУЛЬФИДНЫЕ ВОДЫ — Большая Медицинская Энциклопедия
СУЛЬФИДНЫЕ ВОДЫ (сероводородные воды) — минеральные воды, концентрация сульфидов в к-рых составляет не менее 10 мг/л. С. в. используют в профилактических целях и для лечения ряда заболеваний детей и взрослых.
По содержанию сульфидов С. в. делят на слабосульфидные (10— 50 мг/л), среднесульфидные (50— 100 мг/л), крепкие сульфидные (100—250 мг/л), очень крепкие сульфидные (250—500 мг/л), ультракрепкие сульфидные (>500 мг/л).
Минерализация С. в. и их температура варьируют в широких пределах (см. Минеральные воды). В природных С. в. содержатся также азот (см.), метан (см.), углекислота (см. Ангидрид угольной кислоты), сульфаты (см.), кальций (см.), магний (см.), натрий (см.), хлор (см.).
СССР исключительно богат месторождениями С. в. Они широко распространены во многих артезианских бассейнах Европейской части страны и республик Средней Азии. С. в. успешно используются для бальнеотерапии (см.) на многих курортах, в санаториях и бальнеолечебницах Приуралья — Сергиевских Минеральных Водах (см.), Усть-Качке (см.), Ключах и др., Прикарпатья — Немирове, Любене-Великом (см.), Трускавце (см.), Северного Кавказа — Горячем Ключе (см.), Тамиске, Тал-ги, Серноводске-Кавказском, Закавказья — Менджи, Шихове и др., Туркмении — Арчмане, Узбекистана — Чимионе, Таджикистана — Уч-Кызыле и др., Латвии — Кемери (см.) и др. (см. Курорты). Наиболее известным и крупным месторождением С. в. в СССР является Мацестинское — Сочинское (см. Сочи) и Талги в Дагестанской АССР. Разработаны довольно простые методы приготовления С. в. любой концентрации. Эти воды успешно применяют для лечения на курортах, где нет природных С. в. ив леч. учреждениях вне курортов.
Леч. свойства природных С. в. были известны людям еще в древности. Научное обоснование леч. применения С. в. относится к концу 19 в. Этому способствовали исследования С. А. Смирнова, позже И. А. Ойвина и др. После Великой Октябрьской социалистической революции изучение свойств С. в. и развитие принципов терапии С. в. продолжалось в работах И. А. Валединского, Н. П. Правдина, А. И. Нестерова, М. М. Шихова и др.
В леч. целях используют природные и искусственно приготовленные С. в. в виде общих и (реже) местных ванн (см. Ванны), орошений, микроклизм (см. Клизмы). Температура воды, применяемой для общих ванн, 35—37°, концентрация сульфидов 50—200 мг/л, продолжительность процедуры 8—12 мин., процедуры назначают через день или подряд два дня с последующим перерывом в один день. Курс состоит из 12—14 процедур. При щадящей методике лечения (особенно в отношении пожилых людей) продолжительность процедуры уменьшают до 5—10 мин., концентрацию сульфидов в воде — до 50—75 мг/л, число процедур на курс — до 8—10. При интенсивной методике лечения продолжительность процедуры составляет 10— 15 мин., концентрация сульфидов в воде, используемой для ванны, 100—200 мг/л, число процедур на курс 12—15. Для местных ванн (ручных или ножных) применяют С. в. подогретые до 36—38°, продолжительность процедуры 10—20 мин., ежедневно или через день, на курс 12—20 процедур,. После приема ванны больной должен отдохнуть не менее 20—30 мин. (желательно лежа) в комнате отдыха, продолжая отдых в палате или дома (при амбулаторном лечении).
Детям ванны с С. в. назначают начиная с невысоких концентраций сульфидов (25—50 мг/л), с учетом возраста ребенка и характера заболевания. В дальнейшем при необходимости концентрацию сульфидов в воде, используемой для ванны, можно довести до 100 мг/л. Длительность процедуры постепенно увеличивают с 4—6 до 10 мин., температура воды 36—37°. На курс назначают 8—10 ванн через день.
С. в. применяют для орошений (влагалища, головы, десен и др.). Концентрация сульфидов в воде при этом составляет 100—150 мг/л, хотя может достигать 200 мг/л при температуре 36—38°. Процедуры проводят через день и два дня подряд с перерывом на 3-й день, всего на курс 10—20 процедур.
Для микроклизм используют С. в. с концентрацией сульфидов 50— 100 мг/л при температуре 36—37°, однократная доза 50 мл, процедуры проводят ежедневно или через день, на курс 10—12 процедур.
Механизм действия С. в., кроме механического и температурного раздражения, основан гл. обр. на фар-макол. эффекте сульфидов, что определяет характер назначений соответствующих бальнеопроцедур. Количество прошедших через кожу гидросульфид- и сульфид-ионов тем больше, чем выше их концентрация в используемых С. в., больше площадь кожи, подвергающейся воздействию минеральной воды, и больше продолжительность процедуры. Установлено, что, проникнув в кровь, сульфиды проходят через гематоэнцефалический барьер и через нек-рое время обнаруживаются в ликворе в свободном и связанном виде.
Обладая фармакол. активностью, сульфиды оказывают и рефлекторно-резорбтивное действие на различные органы и системы организма; особенно чувствительны к их действию нервные структуры. Установлено нормализующее действие ванн из С. в. на функциональное состояние ц. н. с., а также экстероцепторов кожи. Ванны из С. в. оказывают выраженное влияние на кровообращение, вызывают расширение капилляров и прекапиллярных артерий (что проявляется гиперемией кожи), увеличение скорости кровотока, объема циркулирующей крови в единицу времени, ударного и минутного объема крови. Под влиянием сульфидных вод урежается пульс, уменьшается число дыхательных движений в минуту, дыхание становится глубже.
Являясь сильными восстановителями, сульфид-ионы в клетках вступают в окислительно-восстановительные реакции (см.) с белками, в т. ч. с ферментами, и с другими физиологически активными соединениями. Благоприятное действие С. в. на ц. н. с., центральную и периферическую гемодинамику, состояние системы иммунитета и др. позволяет использовать эти процедуры при лечении различных патол. состояний.
Показаниями к применению С. в. служат заболевания сер-дечно-сосудистой и нервной систем, опорно-двигательного аппарата, женских половых органов, болезни кожи, хрон. интоксикации солями тяжелых металлов (свинца, ртути и др.), токсические полиневриты, энцефалиты, вибрационная болезнь.
Противопоказания к использованию С. в. те же, что и для других бальнеотерапевтических факторов (все заболевания в острой стадии, сердечно-сосудистые заболевания с нарушением кровообращения II — III степени, далеко зашедший атеросклероз с выраженным поражением сосудов сердца и головного мозга, стенокардия с часто повторяющимися приступами и др.). Кроме того, С. в. противопоказаны при хрон. заболеваниях печени и желчевыводящих путей (при обострении заболевания в течение последнего года и неполной ремиссии), а также при бронхиальной астме, заболеваниях почек и туберкулезе легких.
См. также Санаторно-курортный отбор.
Библиография: Бальнеотерапия при заболеваниях в детском возрасте, под ред. Т. В. Карачевцевой, с. 55, М.,1980; Вопросы сероводородной терапии нервных заболеваний, под ред. К. Ф. Никитина и Е. 3. Неймарка, М., 1964; Сульфидные воды СССР, под ред. В. В. Иванова, М., 1977; Bogoljubow W. М., S с h i-s с h 1 о М. A. u. К u b 1 i S. Ch. Anpas-sungsreaktionen des Organismus und intra-zellulare bioenergetische Prozesse unter Einwirkung physischer Faktoren, Z. Phy-siother., S. 81, 1980.
В. В. Иванов, В. Т. Олефиренко.
xn--90aw5c.xn--c1avg
Сульфиды в воде - Справочник химика 21
Метод определения серы хроматным способом заключается в сжигании нефтепродукта в тигле со смесью перекиси марганца и безводного углекислого натрия, в растворении образовавшихся сульфидов в воде и определении в полученном растворе содержания серы объемным хроматным способом. [c.187]Болты из кремнистой бронзы склонны к эрозионной коррозии под действием падающих капель воды присутствие сульфидов в воде усиливает коррозию. [c.201]
Сжигание навески со смесью перекиси марганца и углекислого натрия, растворение сульфидов в воде, определение серы объемным хроматным способом 1431—64 [c.224]
Сульфиды. МпЗ получают действием сернистого аммония или растворов сульфидов щелочных металлов на соли Мп(П). При длительном стоянии или нагревании осадок темного цвета переходит в более устойчивую модификацию зеленого цвета. Известны три модификации МпЗ [551]. а-МпЗ — зеленые кристаллы кубической сингонии (алабандин), -МпЗ — красные кристаллы кубической сингонии, "у-МиЗ—красные кристаллы гексагональной сингонии. МпЗ относится к напболее растворимым сульфидам, ибо с изменением электронной структуры катионов изменяется растворимость их сульфидов в воде [743] [c.20]
Сероводородная кислота образует два типа солей сульфиды (в воде растворимы только сульфиды щелочных металлов, аммония, кальция и бария) и гидросульфиды — устойчивы только в растворах. Сульфиды, как соли очень слабой кислоты, подвергаются гидролизу. [c.212]
Поскольку сероводород и сульфиды в воде очень неустойчивы и часто окисляются при перевозке пробы, для определения их отбирают отдельную пробу и консервируют ее (см. стр. 12). [c.73]
Применение сульфата алюминия для коагуляции нефтесодержащих сточных вод в узле физико-химической очистки является одним из недостатков схемы, так как увеличивается содержание сульфидов в воде, возвращаемой в оборотные системы завода. Кроме того, требуются значительные капитальные и эксплуатационные затраты на строительство и эксплуатацию реагентного хозяйства. Одно из прогрессивных направлений совершенствования этого узла заключается в замене сульфата алюминия высокомолекулярными полиэлектролитами, дозы которых значительно меньше. Использование флокулянтов позволяет получить менее влажный осадок (90 против 98 %), занимающий меньший объем (1,5—3% против 6—10% от общего количества обрабатываемых сточных вод). [c.200]
И. ОПРЕДЕЛЕНИЕ СУЛЬФИДОВ В ВОДЕ ПО ОБРАЗОВАНИЮ МЕТИЛЕНОВОГО ГОЛУБОГО [c.351]
От 1 и II групп катионов эта группа отличается нерастворимостью соответствуюи их сульфидов в воде, которые, однако, легко растворяются в разбавленных кислотах, что отличает III группу от IV и V групп. [c.306]
Скорость окисления сульфидов в воде зависит от различных факторов концентрации этих соединений в воде, температуры, pH п др. Эти факторы имеют особенно важное значение при решении вопроса о скорости возмон ного самоочищения естественных водоемов от сернистых соединений при спуске производственных сточных вод. [c.57]
Ион —анион сероводородной кислоты, представляющий собой раствор сероводорода в воде. Сероводородная кислота — слабая кислота и сильный восстановитель. Ион бесцветен. Нормальные соли сероводородной кислоты называются сернистыми или сульфидами, кислые соли — кислыми сернистыми или гидросульфидами. Сульфиды щелочных и щелочноземельных металлов и аммония растворимы в воде, другие сульфиды в воде нерастворимы. [c.152]
Рассчитайте растворимость приведенных ниже сульфидов в воде, сначала пренебрегая реакцией S как основания, а затем учитывая основные свойства 52- (допуская, что катионы не реагируют с Н2О) [c.135]
Метод определения растворенных сульфидов ИСО 10530 устанавливает метод определения растворенных сульфидов в воде и в сточных водах в диапазоне концентраций 0,04—1,5 мг/л. Более высокие концентрации определяют путем разбавления пробы. Этот метод применим к пробам воды, требующим фильтрации. [c.280]
Метод определения ионов сульфида в воде [c.505]
Соли сероводородной кислоты называют сульфидами. В воде растворимы только сульфиды щелочных металлов, бария и аммония. Сульфиды остальных металлов практически не растворимы в воде, они выпадают в осадок при введении в растворы солей металлов раствора сульфида аммония (Nh5>2S. Многие сульфиды ярко окрашены. [c.439]
От катионов 3—5-й групп Са", Зг" и Ва" отличаются хорошей растворимостью сульфидов в воде. [c.94]
VI. 2.3. Определение сульфидов в воде [12, 13] [c.192]
Осадок сульфида кадмия растворяют в титрованном растворе йода, избыток которого оттитровывают тиосульфатом. Поскольку сульфиды в воде очень неустойчивы, пробы для их определения необходимо консервировать или раствором ацетата кадмия, или 50%-ным раствором едкого натра. [c.84]
Четвертая аналитическая группа характеризуется тем, что сульфиды элементов, образующих эту группу, нерастворимы в воде, в разбавленных кислотах (кроме азотной) и в полисульфиде аммония. Нерастворимость сульфидов в воде отличает их от сульфидов элементов первой и второй аналитических групп,а нерастворимость в разбавленных кислотах—от сульфидов элементов третьей аналитической группы наконец, нерастворимость сульфидов в полисульфиде аммония отличает эту группу от пятой аналитической группы. [c.442]
В неорганическом и техническом анализе нефелометрическим путем определяют хлор, серу, кальций и др. Наиболее широкое применение нашел этот метод для определения малых количеств веществ. Нефелометрическим путем определяют хлор в воде, примеси хлоридов в солях, сульфаты и сульфиды в воде и солях. Предложены нефелометрические методы определения фосфора в металле и кальция в шлаках, но широкого применения эти методы не нашли. Значительное применение нашли нефелометрические методы в практике органического анализа. В последнее время нефелометрию начали использовать в практике микроанализа. [c.70]
Результаты опытов по контактному биохимическому окислению сульфидов представлены на графике (рис. 3). Из этого графика видно, что при начальной концентрации сульфидов в воде, поступившей на контактную очистку, равной 51—56 мг/л (в пересчете на НгЗ), окисление основного количества сульфидов происходило в течение первых 2 ч аэрации, при этом остаточная концентрация сульфидов в
www.chem21.info
Сульфиды сточных водах - Справочник химика 21
Полисульфид натрия может быть получен также из сульфида или гидросульфида натрия взаимодействием с серой [8]. При этом не образуются побочные сернистые соединения (сульфит или тиосульфат натрия), что значительно упрощает проблему очистки сточных вод производства полисульфидных полимеров. [c.554]Нефтепромысловые сточные воды могут быть заражены сульфатвосстанавливающими бактериями. Образующийся в результате сульфатредукции сероводород ухудшает качество нефти и газа. При этом повышается коррозионная активность воды, появляется возможность образования гипса в скважинах. Тонкодисперсный сульфид железа и бактериальная биомасса забивают коллекторы, снижая проницаемость пород и нефтеотдачу. [c.339]
На рис. 98 представлена печь КС для термического обезвреживания сточных вод, содержащих сульфиды и сульфаты. [c.256]
Различают анаэробные бактерии, жизнедеятельность которых может протекать при отсутствии кислорода, и аэробные - только в присутствии кислорода. Наибольшую опасность представляют анаэробные сульфатвосстанавливающие бактерии, которые широко распространены в природе и развиваются в илистых, глинистых и болотных грунтах, грязи, сточных водах, нефтяных скважинах, донных осадках, почве, цементе, где возникают анаэробные условия. Наиболее благоприятной средой для развития этих бактерий являются грунты с pH = 5-9 (оптимально 6-7,5) при температуре 25-30 °С. Бактерии восстанавливают содержащиеся в грунте сульфаты, используя образующийся при катодном процессе водород, до сульфид-ионов с выделением кислорода [c.48]
Образование осадков [5.24, 5.55, 5.64]. Очистка сточных вод данным методом заключается в связывании катиона или аниона, подлежащего удалению, в труднорастворимые или слабодиссоции-рованные соединения. Выбор реагента для извлечения аниона, условия проведения процесса зависят от вида соединений, их концентрации и свойств. Очистка сточных вод от ионов цинка, хрома, меди, кадмия, свинца в соответствии с санитарными нормами возможна при получении гидроксидов этих металлов. Более глубокая очистка воды от иона цинка достигается при получении сульфида цинка. Очистка от ионов ртути, мышьяка,- железа также возможна в виде сульфидов ртути, мышьяка и железа. Использование в качестве реагента солей кальция позволяет провести очистку сточных вод от цинк- и фосфорсодержащих соединений. В результате очистки получается суспензия, содержащая труднорастворимые соли, отделение которых возможно методами отстаивания, фильтрации и центрифугирования. [c.492]
Твердые отходы нефтехимических предприятий включают в свой состав разнообразные вещества органического и неорганического происхождения, и по этой причине изучение их свойств и состава связано с большими трудностями. К твердым отходам предприятий нефтехимического синтеза относятся ветошь, пропитанная органическими веществами, активный уголь, иониты и другие адсорбенты. смолы, тяжелые металлы, их соли и окислы, сульфиды, сульфаты, твердая часть нефтяных шламов, избыточный активный ил биологических очистных сооружений и осадки сточных вод. [c.355]
Окисление кислородом воздуха применяется для легкоокисляе-мых соединений, например сульфитов, гипосульфитов, гидросульфитов, сульфидов, этилмеркаптана, гидразингидрата. При температуре 60—120°С, давлении 0,1—0,8 МПа и расходе воздуха 80—150 м /мз стоков эффективность очистки сточных вод от сульфидов достигает 90—95 %. Кислород воздуха применяют при очистке сточных вод от железа, окисляя двухвалентное железо в трехвалентное с последующим отделением от воды гидроксида железа. Процессы окисления воздухом значительно интенсифицируются в присутствии катализаторов. [c.493]
На рис. 3.10 приведена принципиальная схема установки по окислению сульфидов сточных вод кислородом воздуха. Сточная вода, содержащая сульфиды, поступает в приемный резервуар и через теплообменник подается в окислительную колонну. Воздух подается в нижнюю часть колонны. Влага из отработанного воздуха конденсируется в сепараторе, откуда направляется в приемный резервуар. Сточные воды после окисления охлаждаются в холодильнике и направляются на дальнейшую очистку. Необработанная сточная вода подогревается водяным паром и теплом конденсата. [c.109]
Биохимическая очистка сточных вод основана на способности некоторых микроорганизмов питаться растворенными в воде органическими и некоторыми неорганическими веществами, например, сульфидами, солями аммония и др. В процессе потребления этих веществ происходит их окисление кислородом, растворенным в воде. Часть окисляемого микроорганизмами вещества используется для увеличения биомассы, а другая превращается в безвредные для водоема продукты — воду, диоксид углерода, нитрат- и сульфат-ионы и др. Микроорганизмы могуг окислять органические вещества при небольшой их концентрации, что является важным достоинством биохимической очистки. [c.320]
Однако в пластовых и сточных водах, содержащих сероводород, кислород, отмечаются скорости коррозии оборудования 6—8 мм/год. В присутствии тионовых сероокисляющих бактерий возможно окисление сульфида железа до сульфат ионов серной кислоты и, в результате, заметное подкисление среды. [c.19]
Соленые сточные воды НПЗ относятся к загрязненным стокам. В них в большом количестве содержатся нефтепродукты, фенолы, сульфиды, поверхностно-активные вещества (ПАВ) и т. д. Однако наиболее существенным для этих стоков является содержание различных минеральных солей, в том числе солей жесткости. [c.4]
Надсмольная вода отделений обработки газа направляется на обесфеноливание после аммиачных колонн, на которых десорбируется большая часть "летучего аммиака , то есть связанного в легко гидролизующиеся карбонат и бикарбонат, сульфид и гидросульфид, цианид аммония. При этом из воды десорбируется большая часть пиридиновых оснований и до 30% содержащихся в ней фенолов. В табл.10.3 приводятся сведения о содержании основных загрязняющих компонентов в сточных водах коксохимического производства. [c.374]
Технологические конденсаты составляют 5—7% всех сточных вод НПЗ с глубокой переработкой нефти. Основными загрязняющими компонентами, содержащимися в технологических конден сатах, являются фенолы, сульфиды и гидросульфиды аммония [c.569]
Растворенные неорганические вещества промышленных сточных вод (минеральные кислоты, сероводород, щелочи, сульфиды, сульфиты, тиосульфаты, соли тяжелых металлов) подвергаются в водоемах чаще всего химическим процессам, что влечет за собой частичное, а иногда и полное исчезновение кислорода в воде и приводит к гибели рыб. [c.217]
www.chem21.info